酸碱中和滴定是最基本的定量分析化学实验.常温下,向50mL0.5mol•L-1HA溶液中逐滴加入0.5mol•L-1强碱MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述
酸碱中和滴定是最基本的定量分析化学实验.常温下,向50mL 0.5mol•L-1 HA溶液中逐滴加入0.5mol•L-1强碱 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述正确的是( )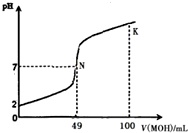
A. 由图中信息可知 HA为强酸,N点为恰好中和
B. 常温下一定浓度的 MA稀溶液的pH<7
C. K点所对应的溶液中离子浓度的大小关系:c(M+)>c(OH-)>c(A-)>c(H+)
D. K点对应的溶液中,溶液的pH>13,c(HA)+c(A-)=0.25mol•L-1
一道java编程题:有一矩阵:a b c d e f g h i j k l m n o p q 2020-04-06 …
英语单词填空(组成单词)1)d.l.e.d.m.i2)l.e.p.o.i.ee3)u.y.g.o. 2020-04-25 …
英语单词辨音找出画()部分读音与其余不同的单词()1.A .kn(ee) B.n(e)ck C.r 2020-05-17 …
一个n脚输入的或门是否能被n-1个二脚输入的或门替代,为什么?顺便问个布尔代数化简M.R.P+Q. 2020-06-20 …
多音字组词。塞sāi()度dù()摩mó()刨páo()sài()duó()mā()bào()号h 2020-06-28 …
下列各项中字音不正确的一项是:()A.瞑(míng)目日暝(míng)冥(míng)顽B.坳(ào 2020-07-02 …
用长L=0.5米的细绳,一端拴一质量m=1千克的小球,另一端固定在离水平桌高h=O.3米.用长L= 2020-07-11 …
推断题:现有如下反应(反应条件均不给),推断物质⑴A→B+C+D⑵C+E→C+F+D⑶D+G→H⑷ 2020-07-30 …
下列有关物质所含元素质量比的数值正确的是A.水(H2O)m(H):m(O)=1:8B.乙炔(C2H2 2020-12-02 …
将下列字母重新排列组将下列字母重新排列组成单词,完成句子.1.Daveishis(u,n,c,o,i 2020-12-17 …