常温下,向100mL0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是()A.HA为一元强酸,MOH为一元弱碱B.N点溶液中离子浓度
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是( )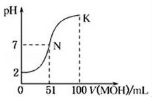
A. HA为一元强酸,MOH为一元弱碱
B. N点溶液中离子浓度大小关系为:c(M+)=c(A-)>c(H+)=c(OH-)
C. N点水的电离程度大于K点水的电离程度
D. N→k之间曲线上任意一点都有c(M+)>c(OH-)>c(A-)>c(H+)
B.N点时溶液呈中性,溶液中存在电荷守恒得到,溶液中c(M+)=c(A-)>c(H+)=c(OH-),故B正确;
C.由图象可知,N点溶液呈中性,水电离的氢离子为10-7mol/l,K点溶液呈碱性,MOH电离的氢氧根离子抑制了水电离,水电离的氢离子小于10-7mol/l,所以N点水的电离程度大于K点水的电离程度,故C正确;
D.在K点时混合溶液体积是碱溶液的2倍,根根据电荷守恒得c(M+)+c(H+)=c(OH-)+c(A-),c(OH-)>c(H+),c(M+)
故选D.
救救菜鸟向5.6克碳酸钙和碳酸镁组成的混合物中加入足量的盐酸,将产生的气体通入500毫升0.2摩尔 2020-04-26 …
还是lingo问题road(country,country):length,xie,c;endse 2020-05-13 …
某研究性学习小组为测定镁和铝的混合物中铝的质量分数,称取该混合物ag某研究性学习小组为测定镁和铝的 2020-05-16 …
高中化学选择题求解!要有详细解析!向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入1. 2020-05-16 …
ansys直接建立有限元模型问题finish/clear/prep7n,1,0,0,0n,2,0, 2020-05-17 …
CO和CO2的混合气体36g,完全燃烧后测得CO2的体积为22.4L(标准状况下).(1)求混合气 2020-06-27 …
设NA为阿伏伽德罗常数的值,下列说法正确的是A,28gN2和N4的混合气体中含有的原子为2NAB, 2020-06-27 …
1、有理数x.y,且|3x+2|+(2y-3)²=0求-x²-y²的值.(汉语翻译:有理数x,y, 2020-07-30 …
设阿伏加德罗常数的值为NA,下列说法正确的是()A.3.1g由白磷和红磷组成的混合物中含有磷原子的数 2020-11-17 …
向一定量的铁氧化铁三氧化二铁和四氧化三铁的混合物中加入200ml4mol/L的稀硝酸,恰好是混合物完 2021-01-13 …