早教吧作业答案频道 -->化学-->
空气中的污染物主要来源为燃煤、机动车尾气等.因此,CO、SO2、NOx等进行研究具有重要意义.请回答下列问题:(1)有人设想,用硫SO2-碘循环分解水制氢,主要涉及下列反应:ⅠSO2+2H2O+I2
题目详情
空气中的污染物主要来源为燃煤、机动车尾气等.因此,CO、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)有人设想,用硫SO2-碘循环分解水制氢,主要涉及下列反应:
ⅠSO2+2H2O+I2=H2SO4+2HI
Ⅱ2HI(g)⇌H2(g)+I2(g)
Ⅲ2H2SO4 (l )⇌2SO2(g)+O2(g)+2H2O(g)
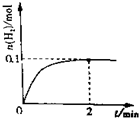
①一定温度下,向2L密闭容器中加入1molHI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示.
0-2min内的平均反应速率v(HI)=___mol/(L•min),
相同温度下,若向2L密闭容器中开始加入的HI(g)物质的量是原来的2倍,则___是原来的2倍.(填字母编号)
A.平衡时I2的物质的量 B.HI的平衡浓度
C.达到平衡的时间 D.平衡时H2的体积分数
②反应Ⅲ平衡常数表达式为___,能说明该反应恒容下达到平衡的标志是___(填字母)
A. 2v正(SO2)=v逆(O2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氧气的体积分数不变
③在CuCl2热溶液中通入SO2气体可制备CuCl沉淀,写出该反应的离子方程式___
(2)为减少CO、SO2污染的排放,常采取的措施有:
①将煤转化为清洁气体燃料.
已知:H2(g)+
O2═H2O(g)△H=-241.8kJ•mol-1
C(s)+
O2═CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:___.
②在含硫燃料中加入石灰石,燃煤生成的SO2即可转化为CaSO4.化学方程式为___.
(3)汽车尾气中NOx和CO的生成及转化
①燃油不完全燃烧时产生CO,有人设想按下列反应除去:2CO(g)=2C(s)+O2(g)
已知该反应的△H>0,简述该设想不能实现的依据:___.
②已知汽缸中生成NO的反应为:N2(g)+O2(g)⇌2NO(g)△H>0
若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=___.
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为___.

(1)有人设想,用硫SO2-碘循环分解水制氢,主要涉及下列反应:
ⅠSO2+2H2O+I2=H2SO4+2HI
Ⅱ2HI(g)⇌H2(g)+I2(g)
Ⅲ2H2SO4 (l )⇌2SO2(g)+O2(g)+2H2O(g)
①一定温度下,向2L密闭容器中加入1molHI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示.
0-2min内的平均反应速率v(HI)=___mol/(L•min),
相同温度下,若向2L密闭容器中开始加入的HI(g)物质的量是原来的2倍,则___是原来的2倍.(填字母编号)
A.平衡时I2的物质的量 B.HI的平衡浓度
C.达到平衡的时间 D.平衡时H2的体积分数
②反应Ⅲ平衡常数表达式为___,能说明该反应恒容下达到平衡的标志是___(填字母)
A. 2v正(SO2)=v逆(O2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氧气的体积分数不变
③在CuCl2热溶液中通入SO2气体可制备CuCl沉淀,写出该反应的离子方程式___
(2)为减少CO、SO2污染的排放,常采取的措施有:
①将煤转化为清洁气体燃料.
已知:H2(g)+
| 1 |
| 2 |
C(s)+
| 1 |
| 2 |
写出焦炭与水蒸气反应的热化学方程式:___.
②在含硫燃料中加入石灰石,燃煤生成的SO2即可转化为CaSO4.化学方程式为___.
(3)汽车尾气中NOx和CO的生成及转化
①燃油不完全燃烧时产生CO,有人设想按下列反应除去:2CO(g)=2C(s)+O2(g)
已知该反应的△H>0,简述该设想不能实现的依据:___.
②已知汽缸中生成NO的反应为:N2(g)+O2(g)⇌2NO(g)△H>0
若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=___.
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为___.
▼优质解答
答案和解析
(1)①根据图知,达到平衡时n(H2)=0.1mol,根据方程式知,消耗的n(HI)=2n(H2)=2×0.1mol=0.2mol,v(HI)=
=
mol/(L.min)=0.05mol/(L.min); 相同温度下,若向2L密闭容器中开始加入的HI(g)物质的量是原来的2倍,相当于增大压强平衡不移动,则HI的转化率不变,所以平衡时碘物质的量、HI浓度都是原来的2倍,所用时间缩短、氢气体积分数不变,
故答案为:0.05;AB;
②该反应平衡常数表达式为K=c2(SO2).c(O2).c2(H2O),
A.当v正(SO2)=2v逆(O2) 时反应达到平衡状态,所以 2v正(SO2)=v逆(O2)时反应没有达到平衡状态,故错误;
B.反应前后气体总物质的量增大,所以反应前后压强增大,当密闭容器中总压强不变时,正逆反应速率不变,反应达到平衡状态,故正确;
C.反应前后气体质量增大、容器体积不变,所以反应前后气体密度增大,当密闭容器中混合气体的密度不变时,正逆反应速率相等,反应达到平衡状态,故正确;
D.无论反应是否达到平衡状态,密闭容器中氧气的体积分数始终不变,不能据此判断平衡状态,故错误;
故答案为:K=c2(SO2).c(O2).c2(H2O);BC;
③氯化铜和二氧化硫发生氧化还原反应生成CuCl和硫酸,离子方程式为2Cu2++2Cl-+SO2+2H2O
2CuCl↓+4H++SO42-,
故答案为:2Cu2++2Cl-+SO2+2H2O
2CuCl↓+4H++SO42-;
(2)①i.H2(g)+
O2═H2O(g)△H=-241.8kJ•mol-1
ii.C(s)+
O2═CO(g)△H=-110.5kJ•mol-1
将方程式ii-i得C (s)+H2O(g)═CO (g)+H2 (g),△H=(-110.5kJ•mol-1)-(-241.8kJ•mol-1
)=+131.3kJ/mol;
故答案为:C (s)+H2O(g)═CO (g)+H2 (g);△H=+131.3kJ/mol;
②高温条件下,二氧化硫和碳酸钙、氧气反应生成硫酸钙和二氧化碳,反应方程式为2SO2+2CaCO3+O2
2CaSO4+2CO2,
故答案为:2SO2+2CaCO3+O2
2CaSO4+2CO2;
(3)①反应是焓增、熵减的反应,△G=△H-T△S>0,所以任何温度下都不自发,
故答案为:该反应是焓增熵减的反应,所以在任何温度下都不自发;
②设容器体积为1L,
N2(g)+O2(g)⇌2NO(g)
开始(mol/L)0.8 0.2 0
反应(mol/L)4×10-4 4×10-4 8×10-4
平衡(mol/L)0.8-4×10-4 0.2-4×10-48×10-4
K=
=4×10-6,
故答案为:4×10-6;
③在催化剂条件下,CO和NO反应生成二氧化碳和氮气,反应方程式为2CO+2NO
2CO2+N2,
故答案为:2CO+2NO
2CO2+N2.
| ||
| △t |
| ||
| 2 |
故答案为:0.05;AB;
②该反应平衡常数表达式为K=c2(SO2).c(O2).c2(H2O),
A.当v正(SO2)=2v逆(O2) 时反应达到平衡状态,所以 2v正(SO2)=v逆(O2)时反应没有达到平衡状态,故错误;
B.反应前后气体总物质的量增大,所以反应前后压强增大,当密闭容器中总压强不变时,正逆反应速率不变,反应达到平衡状态,故正确;
C.反应前后气体质量增大、容器体积不变,所以反应前后气体密度增大,当密闭容器中混合气体的密度不变时,正逆反应速率相等,反应达到平衡状态,故正确;
D.无论反应是否达到平衡状态,密闭容器中氧气的体积分数始终不变,不能据此判断平衡状态,故错误;
故答案为:K=c2(SO2).c(O2).c2(H2O);BC;
③氯化铜和二氧化硫发生氧化还原反应生成CuCl和硫酸,离子方程式为2Cu2++2Cl-+SO2+2H2O
| ||
故答案为:2Cu2++2Cl-+SO2+2H2O
| ||
(2)①i.H2(g)+
| 1 |
| 2 |
ii.C(s)+
| 1 |
| 2 |
将方程式ii-i得C (s)+H2O(g)═CO (g)+H2 (g),△H=(-110.5kJ•mol-1)-(-241.8kJ•mol-1
)=+131.3kJ/mol;
故答案为:C (s)+H2O(g)═CO (g)+H2 (g);△H=+131.3kJ/mol;
②高温条件下,二氧化硫和碳酸钙、氧气反应生成硫酸钙和二氧化碳,反应方程式为2SO2+2CaCO3+O2
| ||
故答案为:2SO2+2CaCO3+O2
| ||
(3)①反应是焓增、熵减的反应,△G=△H-T△S>0,所以任何温度下都不自发,
故答案为:该反应是焓增熵减的反应,所以在任何温度下都不自发;
②设容器体积为1L,
N2(g)+O2(g)⇌2NO(g)
开始(mol/L)0.8 0.2 0
反应(mol/L)4×10-4 4×10-4 8×10-4
平衡(mol/L)0.8-4×10-4 0.2-4×10-48×10-4
K=
| (8×10-4)2 |
| (0.8-4×10-4).(0.2-4×10-4) |
故答案为:4×10-6;
③在催化剂条件下,CO和NO反应生成二氧化碳和氮气,反应方程式为2CO+2NO
| ||
故答案为:2CO+2NO
| ||
看了空气中的污染物主要来源为燃煤、...的网友还看了以下:
人轮状病毒是一种双链RNA病毒,主要感染小肠上皮细胞,可使机体出现呕吐,腹泻等症状导致脱水.以下相 2020-05-13 …
急性肾小球肾炎的主要发病机制是A.链球菌直接感染B.病毒感染C.葡萄球菌感染D.感染后抗原一抗体免 2020-06-06 …
人轮状病毒是一种双链RNA病毒,主要感染小肠上皮细胞,可使机体出现呕吐、腹泻等症状导致脱水,以下相 2020-06-19 …
雾霾天气的频繁出现严重影响了我国居民的生活健康.研究显示其中首要污染物为可吸入颗粒物PM2.5,燃 2020-07-13 …
人轮状病毒是一种双链RNA病毒,主要感染小肠上皮细胞,可使机体出现呕吐,腹泻等症状导致脱水.以下相 2020-07-14 …
科学家将男女体细胞内的23对染色体进行分析整理,形成了下面的排序图.请分析回答:(1)染色体的主要成 2020-11-14 …
图1图2是科学家将男女体细胞内的33对染色体进行分析整理,形成了的排序图,图3是人类某遗传病图解,请 2020-11-14 …
随着我国经济的发展,摩托车、小汽车进入家庭成为日常主要交通工具.大量的机动车所排放的尾气也逐步成为我 2020-12-13 …
根据研究病毒感染机制中拍到的噬菌体侵染大肠杆菌过程及如图的某项实验结果,判断以下说法正确的是()A. 2021-01-05 …
从中央电视台发布的重点城市空气质量日报可看到,造成空气污染的首要污染物是可吸入颗粒和二氧化硫.下列对 2021-01-30 …