早教吧作业答案频道 -->化学-->
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:(1)氧元素能形成繁多的氧化物,请
题目详情
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
(1)氧元素能形成繁多的氧化物,请写出一个与CO2等电子的化合物___;
(2)把Na2O、SiO2、P2O5三种氧化物按熔沸点由高到低顺序排列___;
(3)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为___;
(4)Se原子基态核外电子的排布式为___;
(5)SO32-离子中硫原子的杂化方式___,该离子的立体构型为___;
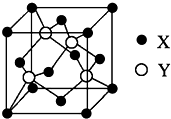
(6)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.X与Y所形成化合物晶体的晶胞如图所示.
①在一个晶胞中,X离子的数目___,该化合物的化学式为___;
②Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是___;
③Y与Z可形成YZ42-.YZ42-的空间构型为___(用文字描述);写出一种与YZ42-互为等电子体的分子的化学式___;
④X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ 键的数目为___.

(1)氧元素能形成繁多的氧化物,请写出一个与CO2等电子的化合物___;
(2)把Na2O、SiO2、P2O5三种氧化物按熔沸点由高到低顺序排列___;
(3)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为___;
(4)Se原子基态核外电子的排布式为___;
(5)SO32-离子中硫原子的杂化方式___,该离子的立体构型为___;
(6)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.X与Y所形成化合物晶体的晶胞如图所示.
①在一个晶胞中,X离子的数目___,该化合物的化学式为___;
②Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是___;
③Y与Z可形成YZ42-.YZ42-的空间构型为___(用文字描述);写出一种与YZ42-互为等电子体的分子的化学式___;
④X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ 键的数目为___.
▼优质解答
答案和解析
(1)原子总数相等价电子总数相等的微粒互为等电子体,与CO2等电子的化合物为N2O等;
故答案为:N2O等;
(2)Na2O是离子晶体、SiO2是原子晶体、P2O5属于分子晶体,故熔沸点:SiO2>Na2O>P2O5,
故答案为:SiO2>Na2O>P2O5;
(3)同主族自上而下元素第一电离能增大,故第一电离能:O>S>Se,
故答案为:O>S>Se;
(4)Se为34号元素,核外电子排布式为:[Ar]3d104s24p4,
故答案为:[Ar]3d104s24p4;
(5)SO32-离子中硫原子的孤电子对数=
=1,价层电子对数为3+1=4,故S原子采取sp3杂化,该离子的立体构型为:三角锥形,
故答案为:sp3;三角锥形;
(6)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,核外电子数为2+8+18+2=30,则X为Zn;元素Y基态原子的3p轨道上有4个电子,则Y为S元素;元素Z的原子最外层电子数是其内层的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素.
①在一个晶胞中,X离子的数目8×
+6×
=4,Y离子数目为4,该化合物的化学式为ZnO,
故答案为:4;ZnO;
②水分子与乙醇分子之间形成氢键,H2O在乙醇中的溶解度大于H2S,
故答案为:水分子与乙醇分子之间形成氢键;
③SO42-中S原子孤电子对数为
=0,价层电子对数为4+0=4,故其空间结构为正四面体,一种与SO42-互为等电子体的分子的化学式:CCl4或SiCl4,
故答案为:正四面体;CCl4或SiCl4;
④X的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,1mol该配合物中含有12molN-H、4mol配位键,故含有σ 键的数目为16NA,
故答案为:16NA.
故答案为:N2O等;
(2)Na2O是离子晶体、SiO2是原子晶体、P2O5属于分子晶体,故熔沸点:SiO2>Na2O>P2O5,
故答案为:SiO2>Na2O>P2O5;
(3)同主族自上而下元素第一电离能增大,故第一电离能:O>S>Se,
故答案为:O>S>Se;
(4)Se为34号元素,核外电子排布式为:[Ar]3d104s24p4,
故答案为:[Ar]3d104s24p4;
(5)SO32-离子中硫原子的孤电子对数=
| 6+2-2×3 |
| 2 |
故答案为:sp3;三角锥形;
(6)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,核外电子数为2+8+18+2=30,则X为Zn;元素Y基态原子的3p轨道上有4个电子,则Y为S元素;元素Z的原子最外层电子数是其内层的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素.
①在一个晶胞中,X离子的数目8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:4;ZnO;
②水分子与乙醇分子之间形成氢键,H2O在乙醇中的溶解度大于H2S,
故答案为:水分子与乙醇分子之间形成氢键;
③SO42-中S原子孤电子对数为
| 6+2-2×4 |
| 2 |
故答案为:正四面体;CCl4或SiCl4;
④X的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,1mol该配合物中含有12molN-H、4mol配位键,故含有σ 键的数目为16NA,
故答案为:16NA.
看了ⅥA族的氧、硫、硒(Se)、碲...的网友还看了以下:
在1~18号元素中,如某元素气态氢化物为HnR,其最高价氧化物水化物分子中含m个氧原子···在1~1 2020-03-30 …
铁在氧气中反应为什么生成的是四氧化三铁?铁离子显 3价,氧离子通常显-2价.铁丝在收集满氧气的一集 2020-04-06 …
“由于CO2和CO中碳分别为+3、+2价,均没达到最高值,故燃烧均生成碳的最高价氧化物CO2”这句 2020-04-25 …
为什么氧不足与碳燃烧会产生一氧化碳而不是产生部分二氧化碳,和剩余碳.也就是问:为什么氧气充足的情况 2020-05-16 …
某金属氧化物跟足量的盐酸反应,生成氧化物和水的分子个数比为2:3,则该金属氧化物中金属元素的化合价 2020-06-11 …
将甲、乙两种非金属的性质相比较,已知:①甲比乙容易与H2化合;②甲原子能与乙的阴离子发生氧化还原反 2020-06-18 …
在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等.将无水硫酸 2020-06-22 …
图中字母代表含硫元素的物质,下列判断错误的是()A.物质a在纯氧中燃烧可以生成物质bB.物质c是二氧 2020-12-24 …
氧化还原反应1.氧化剂:化合价降.得电子.被还原.发生反应.生成还原产物2.还原剂:化合价升.失电子 2020-12-26 …
某有机物燃烧产生二氧化碳和水,1.6g燃烧生成4.4g二氧化碳和3.6g水,确定该物体元素.23g某 2021-01-20 …