早教吧作业答案频道 -->化学-->
氨是重要的氮肥,合成原理为:N2(g)+3H2(g)催化剂高温高压2NH3(g)△H=-92.4kJ•mol-1.回答下列问题:在500℃、20MPa时,将N2、H2置于一个容
题目详情
氨是重要的氮肥,合成原理为:N2(g)+3H2(g)
2NH3(g)△H=-92.4kJ•mol-1.回答下列问题:在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各种物质的物质的量随时间的变化如图1所示,回答下列问题:
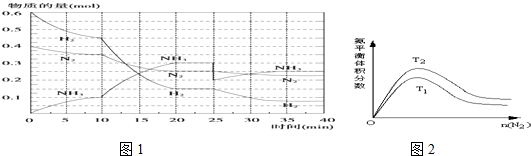
(1)10min内 以NH3表示的平均反应速率为___
(2)在10~20min内,NH3浓度变化的原因可能是___
A.使用了催化剂 B.缩小容器体积 C.降低温度 D.增加NH3物质的量
(3)第2次平衡时NH3的体积分数___;
(4)在反应进行至25min时,曲线发生变化的原因:___达第二次平衡时,新平衡的平衡常数K2___K1(填“大于”、“小于”或“等于”).
(5)一定条件下NH3的平衡体积分数随n(N2)变化如图2所示 (T-温度).则T2___T1 (填>、=、<),判断的依据是:___.
| 催化剂 |
| |
| 高温高压 |

(1)10min内 以NH3表示的平均反应速率为___
(2)在10~20min内,NH3浓度变化的原因可能是___
A.使用了催化剂 B.缩小容器体积 C.降低温度 D.增加NH3物质的量
(3)第2次平衡时NH3的体积分数___;
(4)在反应进行至25min时,曲线发生变化的原因:___达第二次平衡时,新平衡的平衡常数K2___K1(填“大于”、“小于”或“等于”).
(5)一定条件下NH3的平衡体积分数随n(N2)变化如图2所示 (T-温度).则T2___T1 (填>、=、<),判断的依据是:___.
▼优质解答
答案和解析
(1)反应速率=
=
=0.005mol/(L.min),
故答案为:0.005mol/(L.min);
(2)由图可知,0-10分钟内△n(N2)=0.025mol×2=0.05mol;10-20分钟内△n′(N2)=0.025mol×4=0.1mol,速率之比等于物质的量之比,所以,0-10分钟与10到20分钟两个时间段中,N2的反应速率之比为0.05mol:0.1mol=1:2;
由图象可知各组分物质的量变化增快,且10min时变化是连续的,20min达平衡时,△n′(N2)=0.025mol×4=0.1mol,
△n(H2)=0.025mol×12=0.3mol,△n(NH3)=0.025mol×8=0.2mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,
故选A;
(3)第2次平衡时NH3的体积分数=
=45.5%,
故答案为:45.5%;
(4)第25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3,因为平衡常数仅与温度有关,所以K2等于K1;
故答案为:分离出0.1molNH3;等于;
(5)合成氨反应是放热反应,随着反应进行,体系温度逐渐升高,所以化学平衡会逆向移动,导致NH3的体积分数下降,即温度越高,NH3的体积分数越小,所以T2<T1,
故答案为:<;合成氨反应是放热反应,温度升高,平衡向逆反应方向移动,NH3的体积分数下降,所以T1>T2.
| ||
| △t |
| ||
| 10min |
故答案为:0.005mol/(L.min);
(2)由图可知,0-10分钟内△n(N2)=0.025mol×2=0.05mol;10-20分钟内△n′(N2)=0.025mol×4=0.1mol,速率之比等于物质的量之比,所以,0-10分钟与10到20分钟两个时间段中,N2的反应速率之比为0.05mol:0.1mol=1:2;
由图象可知各组分物质的量变化增快,且10min时变化是连续的,20min达平衡时,△n′(N2)=0.025mol×4=0.1mol,
△n(H2)=0.025mol×12=0.3mol,△n(NH3)=0.025mol×8=0.2mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,
故选A;
(3)第2次平衡时NH3的体积分数=
| 2.5mol |
| 2.5mol+2.25mol+0.75mol |
故答案为:45.5%;
(4)第25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3,因为平衡常数仅与温度有关,所以K2等于K1;
故答案为:分离出0.1molNH3;等于;
(5)合成氨反应是放热反应,随着反应进行,体系温度逐渐升高,所以化学平衡会逆向移动,导致NH3的体积分数下降,即温度越高,NH3的体积分数越小,所以T2<T1,
故答案为:<;合成氨反应是放热反应,温度升高,平衡向逆反应方向移动,NH3的体积分数下降,所以T1>T2.
看了 氨是重要的氮肥,合成原理为:...的网友还看了以下:
已知函数f(x)=ex(ax+2)(e为自然对数的底数,a∈R为常数).对于函数g(x),h(x) 2020-05-13 …
高中数学,几何急!已知椭圆G:x^2/a^2+y^2/b^2=1(a>b>0)的离心率为1/2过椭 2020-05-14 …
有关拉格朗日定理(群论)的问题拉格朗日定理如下:设是群的一个子群,那么R={|a属于G,b属于G, 2020-05-17 …
静止在桌子上的书本对桌子的压力考虑弹力一本书重力为G,在桌子上放着.桌子和书有微小形变.问:书对桌 2020-05-22 …
玉汝于成是什么意思? 2020-05-22 …
函数与其自己的反函数复合后等于x,怎么证明呢?假设f是g的反函数,于是对定义域内的x,存在y使得, 2020-06-08 …
如图所示,f(x)是定义在区间[-c,c](c>0)上的奇函数,令g(x)=af(x)+b,并有关 2020-06-09 …
请问您可以帮我完成《近似代数》中的几道难题吗?设G是个交换群,证明H={g┃g∈G,g4=e}是G 2020-06-10 …
“艰难困苦,玉汝于成”是啥意思?出自哪?RT. 2020-06-16 …
玉汝于成”是说象玉一样爱护,来帮助你成功.象玉一样? 2020-06-27 …