早教吧作业答案频道 -->化学-->
铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂(每片b克)中铁元素的含量.实验步骤如下:请回答下列问题:(1)步骤②中H2O2的
题目详情
铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂(每片b克)中铁元素的含量.实验步骤如下:
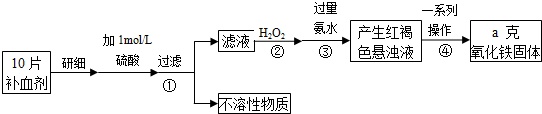
请回答下列问题:
(1)步骤②中H2O2的作用是___.
(2)步骤③所得的红褐色悬浊液中除H2O2、氨水外主要还含___和___(填化学式).
(3)步骤④中一系列处理的操作步骤为___、洗涤、灼烧、冷却、称量.
(4)实验中用已经准确量取的浓硫酸配制100mL 1mol/L的硫酸溶液,则配制时用到的仪器除烧杯、玻璃棒,还有两种仪器是___、___.
(5)下列操作会导致所测定的铁元素含量偏高的是___
A.步骤③所加氨水量不足 B.步骤④洗涤不充分 C.步骤④灼烧不充分
(6)若实验无损耗,则每片补血剂含铁元素的质量分数为___(用含字母的代数式表示).
(7)聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)n]m取一定质量聚合硫酸铁样品与足量盐酸反应,所得溶液平均分为两份,一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.7475g.另一份溶液,先将Fe3+还原为Fe2+,再用0.02000mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液50.00mL.计算求出聚合硫酸铁样品中a:b的比值. (已知:Cr2O72一十6Fe2+十14H+═2Cr3+十6Fe3+十7H2O)(无计算过程不给分)

请回答下列问题:
(1)步骤②中H2O2的作用是___.
(2)步骤③所得的红褐色悬浊液中除H2O2、氨水外主要还含___和___(填化学式).
(3)步骤④中一系列处理的操作步骤为___、洗涤、灼烧、冷却、称量.
(4)实验中用已经准确量取的浓硫酸配制100mL 1mol/L的硫酸溶液,则配制时用到的仪器除烧杯、玻璃棒,还有两种仪器是___、___.
(5)下列操作会导致所测定的铁元素含量偏高的是___
A.步骤③所加氨水量不足 B.步骤④洗涤不充分 C.步骤④灼烧不充分
(6)若实验无损耗,则每片补血剂含铁元素的质量分数为___(用含字母的代数式表示).
(7)聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)n]m取一定质量聚合硫酸铁样品与足量盐酸反应,所得溶液平均分为两份,一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.7475g.另一份溶液,先将Fe3+还原为Fe2+,再用0.02000mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液50.00mL.计算求出聚合硫酸铁样品中a:b的比值. (已知:Cr2O72一十6Fe2+十14H+═2Cr3+十6Fe3+十7H2O)(无计算过程不给分)
▼优质解答
答案和解析
由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)双氧水具有强氧化性,由流程图可知,加入双氧水目的是将Fe2+全部氧化为Fe3+,
故答案为:将Fe2+全部氧化为Fe3+;
(2)由流程图可知,步骤③是将Fe3+转化为氢氧化铁沉淀,加入氨水反应生成Fe(OH)3 和(NH4)2SO4,故答案为:Fe(OH)3 和(NH4)2SO4;
(3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:过滤;
(4)精确配制100mL 1mol/L的硫酸溶液,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、100mL容量瓶,所以还需要100mL容量瓶、胶头滴管,
故答案为:100mL容量瓶、胶头滴管;
(5)10片补血剂中氧化铁的物质的量为:
mol,含有的铁元素质量为:2×
g=
g,每片补血剂含铁元素的质量分数为:
×100%=
%,
故答案为:
%;
(6)A、步骤③所加氨水量不足,铁离子沉淀不完全,生成的氢氧化铁减少,氧化铁质量减少,测定结果偏低,故A错误;
B、步骤④洗涤不充分,会导致氧化铁的质量偏大,测得的铁元素质量分数偏大,故B正确;
C、步骤④灼烧不充分,会导致氧化铁固体的质量偏大,铁元素质量分数偏大,故C正确;
故选BC;
(7)n(SO42-)=
=0.0075mol,n(K2Cr2O7)=0.05L×0.02mol/=0.001mol,
n(Fe2+)=n(K2Cr2O7)×6=0.006mol,
由电荷守恒可知n(OH-)+n(SO42-)×2=n(Fe3+)×3,n(OH-)=0.006mol×3-0.0075mol×2=0.003mol,
得到a:b=0.006mol:0.003mol=2:1,
故答案为:2:1.
(1)双氧水具有强氧化性,由流程图可知,加入双氧水目的是将Fe2+全部氧化为Fe3+,
故答案为:将Fe2+全部氧化为Fe3+;
(2)由流程图可知,步骤③是将Fe3+转化为氢氧化铁沉淀,加入氨水反应生成Fe(OH)3 和(NH4)2SO4,故答案为:Fe(OH)3 和(NH4)2SO4;
(3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:过滤;
(4)精确配制100mL 1mol/L的硫酸溶液,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、100mL容量瓶,所以还需要100mL容量瓶、胶头滴管,
故答案为:100mL容量瓶、胶头滴管;
(5)10片补血剂中氧化铁的物质的量为:
| a |
| 160 |
| a |
| 160 |
| 7a |
| 10 |
| ||||
| b |
| 7a |
| b |
故答案为:
| 7a |
| b |
(6)A、步骤③所加氨水量不足,铁离子沉淀不完全,生成的氢氧化铁减少,氧化铁质量减少,测定结果偏低,故A错误;
B、步骤④洗涤不充分,会导致氧化铁的质量偏大,测得的铁元素质量分数偏大,故B正确;
C、步骤④灼烧不充分,会导致氧化铁固体的质量偏大,铁元素质量分数偏大,故C正确;
故选BC;
(7)n(SO42-)=
| 1.7475g |
| 233g/mol |
n(Fe2+)=n(K2Cr2O7)×6=0.006mol,
由电荷守恒可知n(OH-)+n(SO42-)×2=n(Fe3+)×3,n(OH-)=0.006mol×3-0.0075mol×2=0.003mol,
得到a:b=0.006mol:0.003mol=2:1,
故答案为:2:1.
看了铁是人体不可缺少的微量元素,硫...的网友还看了以下:
请问星系的数量请问目前宇宙中大约有多少个星系? 2020-04-26 …
冰箱,0.39和0.56分别每天耗电多少?冰箱上面标有耗电量,0.39和0.56.是指冰箱没有任何 2020-06-08 …
一堆木材燃烧后只生成少量的灰烬,灰烬的质量肯定远小于然烧掉的木材的质量.请问,这个变化过程符合质守 2020-06-24 …
必须汽蚀余量请问4米的必须气蚀余量,等于多少大气压,水泵进水多少米才不会气蚀,水泵在水面以上2米, 2020-06-29 …
请问一个地球,一个月亮,他问:81个月亮和一个地球一样重,问月球的质量是的地球质量请问一个地球,一 2020-07-21 …
老挝100万吨铜矿石储量,含量约在4%,也就是4万吨的铜金属储量,请问开采这样的矿山,需要多少投入 2020-07-23 …
高供高计电能表接线错误问题请教:电压比为10000/100V,电流比为20/5A,经查A相电流二次结 2020-11-01 …
3杯水和5杯水的问题,两个杯子,一个杯子里有3杯水的量,一个杯子里有5杯水的量,请至少描述三种方法算 2020-11-23 …
9个硬币问题9个硬币,其中只有一个重量不一样,你只有两只手分别重量,请问至少需要几次掂量才能保证找出 2020-12-03 …
请问将1升25摄氏度的水变成0度的冰块需要释放多少能量?请问将1升25摄氏度的水变成0度的冰块需要释 2020-12-30 …