早教吧作业答案频道 -->化学-->
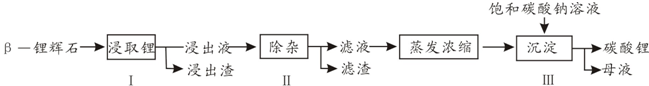
(2010?广东)碳酸锂广泛应用于陶瓷和医药等领域.已β-锂辉石(主要成分为Li2O-Al2O3-4SiO2)为原材料制备Li2CO3的工艺流程如下:已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式
题目详情
(2010?广东)碳酸锂广泛应用于陶瓷和医药等领域.已β-锂辉石(主要成分为Li 2 O-Al 2 O 3 -4SiO 2 )为原材料制备Li 2 CO 3 的工艺流程如下:
已知:Fe 3+ 、Al 3+ 、Fe 2+ 和Mg 2+ 以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li 2 SO 4 、LiOH和Li 2 CO 3 在303K下的溶解度分别为34.2g、12.7g和1.3g.
(1)步骤Ⅰ前,B-锂辉石要粉碎成细颗粒的目的是 ____ .
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li + 、SO 4 2- ,另含有Al 3+ 、Fe 3+ 、Fe 2+ 、Mg 2+ 、Ca 2+ 、Na + 等杂质,需在搅拌下加入 ____ (填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液.
(3)步骤2中,将适量的H 2 O 2 溶液、石灰乳和Na 2 CO 3 溶液依次加入浸出液中,可除去的杂质金属离子有
(4)步骤3中,生成沉淀的离子方程为
(5)从母液中可回收的主要物质是

已知:Fe 3+ 、Al 3+ 、Fe 2+ 和Mg 2+ 以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li 2 SO 4 、LiOH和Li 2 CO 3 在303K下的溶解度分别为34.2g、12.7g和1.3g.
(1)步骤Ⅰ前,B-锂辉石要粉碎成细颗粒的目的是 ____ .
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li + 、SO 4 2- ,另含有Al 3+ 、Fe 3+ 、Fe 2+ 、Mg 2+ 、Ca 2+ 、Na + 等杂质,需在搅拌下加入 ____ (填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液.
(3)步骤2中,将适量的H 2 O 2 溶液、石灰乳和Na 2 CO 3 溶液依次加入浸出液中,可除去的杂质金属离子有
Fe 2+ 、Mg 2+ 、Ca 2+
Fe 2+ 、Mg 2+ 、Ca 2+
(4)步骤3中,生成沉淀的离子方程为
2Li + +CO 3 2- =Li 2 CO 3 ↓
2Li + +CO 3 2- =Li 2 CO 3 ↓
(5)从母液中可回收的主要物质是
Na 2 SO 4
Na 2 SO 4
.▼优质解答
答案和解析
分析: (1)从反应速率的角度来分析;
(2)抓住题目中的“酸性溶液”,“调节溶液的pH到6.0~6.5”,从所给试剂中选择符合条件的药品;
(3)H 2 O 2 是强氧化剂,可把Fe 2+ 氧化成Fe 3+ ,石灰乳和碳酸钠都是沉淀剂,使溶液中的Fe 2+ 、Mg 2+ 、Ca 2+ ;
(4) 分析Li 2 SO 4 、LiOH和Li 2 CO 3 在303K下的溶解度分别为34.2g、12.7g和1.3g可知,Li 2 CO 3 最易沉淀;
(5)由元素守恒可知,母液中存在较多的Na + 、SO 4 2- .
(2)抓住题目中的“酸性溶液”,“调节溶液的pH到6.0~6.5”,从所给试剂中选择符合条件的药品;
(3)H 2 O 2 是强氧化剂,可把Fe 2+ 氧化成Fe 3+ ,石灰乳和碳酸钠都是沉淀剂,使溶液中的Fe 2+ 、Mg 2+ 、Ca 2+ ;
(4) 分析Li 2 SO 4 、LiOH和Li 2 CO 3 在303K下的溶解度分别为34.2g、12.7g和1.3g可知,Li 2 CO 3 最易沉淀;
(5)由元素守恒可知,母液中存在较多的Na + 、SO 4 2- .
(1)固体颗粒越小,化学反应速率越快,同时可使锂元素尽可能多地溶解到酸中,故答案为:(1)增大固液接触面积,加快浸出反应速率,提高浸出率;
(2)所给三种物质中,只有CaCO 3 能够降低溶液的酸度,提高溶液的pH到6.0~6.5,可除去Fe 3+ 、Al 3+ .,故答案为:石灰石;
(3)步骤Ⅱ中加入H 2 O 2 溶液,可将Fe 2+ 氧化为Fe 3+ ,然后加入石灰乳可除去其中的Fe 3+ 和Mg 2+ ,再加入Na 2 CO 3 溶液可除去Ca 2+ .此时溶液中的离子主要有Li + 、Na + 、SO 4 2- ,
故答案为:Fe 2+ 、Mg 2+ 、Ca 2+ ;
(4)步骤Ⅲ加入饱和Na 2 CO 3 溶液后,主要使Li + 转化为Li 2 CO 3 沉淀,故答案为:2Li + +CO 3 2- =Li 2 CO 3 ↓;
(5)反应后,溶液中的Na 2 SO 4 以及加入的过量Na 2 CO 3 便留在母液中,可回收的主要物质为Na 2 SO 4 ,故答案为:Na 2 SO 4 .
(2)所给三种物质中,只有CaCO 3 能够降低溶液的酸度,提高溶液的pH到6.0~6.5,可除去Fe 3+ 、Al 3+ .,故答案为:石灰石;
(3)步骤Ⅱ中加入H 2 O 2 溶液,可将Fe 2+ 氧化为Fe 3+ ,然后加入石灰乳可除去其中的Fe 3+ 和Mg 2+ ,再加入Na 2 CO 3 溶液可除去Ca 2+ .此时溶液中的离子主要有Li + 、Na + 、SO 4 2- ,
故答案为:Fe 2+ 、Mg 2+ 、Ca 2+ ;
(4)步骤Ⅲ加入饱和Na 2 CO 3 溶液后,主要使Li + 转化为Li 2 CO 3 沉淀,故答案为:2Li + +CO 3 2- =Li 2 CO 3 ↓;
(5)反应后,溶液中的Na 2 SO 4 以及加入的过量Na 2 CO 3 便留在母液中,可回收的主要物质为Na 2 SO 4 ,故答案为:Na 2 SO 4 .
点评: 钠、铝、铁、铜及其化合物是日常生活中非常重要的物质,特别是铝、铁在国民经济中占有极其重要的地位.命题的重点将是钠及其化合物(特别是Na 2 O 2 、Na 2 CO 3 、NaHCO 3 )的性质、铝及其化合物的两性、Fe 2+ 与Fe 3+ 之间的转化关系、铜的冶炼及Cu(OH) 2 的性质等.估计以后高考试题将会在选择题中以离子共存、离子方程式、氧化还原反应、物质的鉴别与分离等角度考查金属元素及其化合物的性质,也会在非选择题中以金属元素的性质为载体,通过推断题、实验题,考查考生运用金属元素的有关知识分析解决问题的能力.以实验探究的形式考查元素化合物的性质将成为以后高考命题的新亮点.
看了(2010?广东)碳酸锂广泛应...的网友还看了以下:
1.Seldom____ time to watch TV.A) do I have B) I d 2020-05-16 …
根据句意及首字母提示,写出相应单词.1.i help sick people in the hos 2020-05-16 …
My father got very angry______ A.with that I had 2020-05-16 …
当我们说明一个类C实现一个接口I,下面说法()不正确A.接口I是类C一个超类型B.类C也实现了接口 2020-05-17 …
选出()里读音与其他不同的1.A.c(a)meraB.m(a)nC.h(a)rd2.A.(ea)s 2020-05-22 …
英语单词填空1.时间状语:d-r-n-2.场所:b-s-s-o-f-r--e-a-t-e-t3.教 2020-07-14 …
正方体的6个面分别写着A、c、D、E、F、I.与A、E、I相对的面分别是哪个面?第一个正方形上面是 2020-07-29 …
c#随机字母和数字c=newchar[6];RandomrandomNumber=newRandom 2020-10-30 …
已知i+h=10g+c,f+d=f,10b+c+i=10c+d,10f+a+j=10f+e,11b* 2020-10-30 …
下面是求1~1000内所有偶数的和的程序,把程序框图补充完整,则()A.①处为S=S+i,②处为i= 2020-11-01 …