早教吧作业答案频道 -->化学-->
(氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如图1:(1)稀硫酸与M
题目详情
(氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如图1:
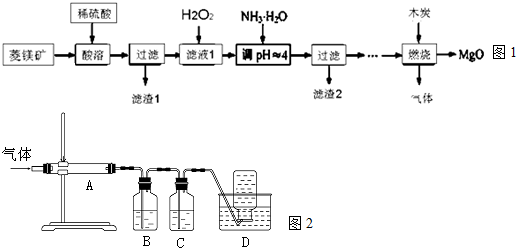
(1)稀硫酸与MgCO3反应的离子方程式为___.
(2)加入H2O2的作用是___,发生反应的离子方程式为___,调溶液pH≈4目的是使___生成沉淀.
(3)煅烧过程存在以下反应:
2MgSO4+C
2MgO+2SO2↑+CO2↑
MgSO4+C
MgO+SO2↑+CO↑
MgSO4+3C
MgO+S↑+3CO↑
利用图2装置对煅烧产生的气体进行分步吸收或收集.
①B中盛放的溶液可以是___(填字母).B中的离子方程式为___.
a.NaOH 溶液 b.Na2CO3溶液 c.稀硝酸 d.KMnO4溶液
②D中收集的气体可以是___(填化学式).
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,该反应中氧化剂与
还原剂的物质的量比___.

(1)稀硫酸与MgCO3反应的离子方程式为___.
(2)加入H2O2的作用是___,发生反应的离子方程式为___,调溶液pH≈4目的是使___生成沉淀.
(3)煅烧过程存在以下反应:
2MgSO4+C
| ||
MgSO4+C
| ||
MgSO4+3C
| ||
利用图2装置对煅烧产生的气体进行分步吸收或收集.
①B中盛放的溶液可以是___(填字母).B中的离子方程式为___.
a.NaOH 溶液 b.Na2CO3溶液 c.稀硝酸 d.KMnO4溶液
②D中收集的气体可以是___(填化学式).
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,该反应中氧化剂与
还原剂的物质的量比___.
▼优质解答
答案和解析
(1)MgCO3与稀硫酸反应生成硫酸镁、二氧化碳和水,反应的离子方程式为MgCO3+2H+═Mg2++CO2↑+H2O,
故答案为:MgCO3+2H+═Mg2++CO2↑+H2O;
(2)加入H2O2 氧化时,在酸性溶液中氧化硫酸亚铁为硫酸铁,反应的化学方程式为:2FeSO4+H2O2+H2SO4═Fe2(SO4)3+2H2O,反应离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,加入氨水调溶液pH≈4,使铁离子全部沉淀,过滤后所以得到沉淀为氢氧化铁,
故答案为:将亚铁离子氧化为铁离子;2Fe2++H2O2+2H+=2Fe3++2H2O;Fe(OH)3;
(3)①B中盛放的溶液可以KMnO4溶液吸收二氧化硫,反应为5SO2+2KMnO4+2H2O═K2SO4 +2MnSO4+2H2SO4,反应离子方程式为:5SO2+2MnO4-+2H2O═2Mn2++4H++5SO42-,
故答案为:d;
②B装置高锰酸钾溶液吸收二氧化硫,通过C中的氢氧化钠溶液吸收二氧化碳,最后剩余一氧化碳气体在D中收集,
故答案为:CO;
③A中得到的淡黄色固体与热的NaOH溶液反应,依据氧化还原反应原理,产物中元素最高价态为+4,最低价为-2价,反应的离子方程式为:3S+6OH-
2S2-+SO32-+3H2O,
该反应中氧化剂为S(2个硫从0→-2),还原剂为S(1个硫从0→+4),两者的物质的量比为2:1,
故答案为:2:1.
故答案为:MgCO3+2H+═Mg2++CO2↑+H2O;
(2)加入H2O2 氧化时,在酸性溶液中氧化硫酸亚铁为硫酸铁,反应的化学方程式为:2FeSO4+H2O2+H2SO4═Fe2(SO4)3+2H2O,反应离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,加入氨水调溶液pH≈4,使铁离子全部沉淀,过滤后所以得到沉淀为氢氧化铁,
故答案为:将亚铁离子氧化为铁离子;2Fe2++H2O2+2H+=2Fe3++2H2O;Fe(OH)3;
(3)①B中盛放的溶液可以KMnO4溶液吸收二氧化硫,反应为5SO2+2KMnO4+2H2O═K2SO4 +2MnSO4+2H2SO4,反应离子方程式为:5SO2+2MnO4-+2H2O═2Mn2++4H++5SO42-,
故答案为:d;
②B装置高锰酸钾溶液吸收二氧化硫,通过C中的氢氧化钠溶液吸收二氧化碳,最后剩余一氧化碳气体在D中收集,
故答案为:CO;
③A中得到的淡黄色固体与热的NaOH溶液反应,依据氧化还原反应原理,产物中元素最高价态为+4,最低价为-2价,反应的离子方程式为:3S+6OH-
| ||
该反应中氧化剂为S(2个硫从0→-2),还原剂为S(1个硫从0→+4),两者的物质的量比为2:1,
故答案为:2:1.
看了(氧化镁在医药、建筑等行业应用...的网友还看了以下:
用天平准确称取纯净的镁带12g,并将其投入到足量的盐酸中完全反应,理论上可收集到的气体在标准状况下的 2020-03-30 …
下列工业制备方法不正确的是()A.工业提取镁是将海水中的镁转化为氯化镁再电解得到单质镁B.工业提取 2020-05-14 …
海水中的镁元素的一些问题,1.镁元素的存在形式(不止一种)以及如何相互转化2.镁元素在深海沉积物中 2020-05-16 …
硫酸钠是制造纸浆、染料稀释剂、医药品等的重要原料.某硫酸钠粗品中含有少量的氯化钙、氯化镁,实验室进 2020-05-17 …
将8.8克的氧化的镁带样品全放入100克的稀盐酸中,完全反应,收集到0.4克的氢气1.求镁带样品中 2020-05-17 …
把5g不纯的镁(杂质不反应,也不溶于水)放入100g稀盐酸中恰好反应,生成氢气0.4g.求:1.样 2020-05-17 …
为什么制纯的氯化镁的时候要先浓缩结晶?制氯化镁通常从从海水中提取:A:在海水中加入石灰水沉降其中氯 2020-05-17 …
有表面被氧化的镁条8.8克,与100克29.4%的稀硫酸刚好完全反应有表面被氧化的镁条8.8克,与 2020-06-03 …
(2003•黑龙江)将10g不纯的氯化镁样品(杂质不溶于水),放入100g水中,充分搅拌,待样品中 2020-06-04 …
某试样为等物质的量的纯Ca2CO3和纯MgCO3混合物,处理后加(NH4)2C2O4得CaC2O4 2020-06-07 …