早教吧作业答案频道 -->化学-->
某工厂用电解饱和食盐水方法生产氯气、烧碱、氢气等化工产品,这种工业称为“氯碱工业”.(反应的化学方程式:2NaCl+2H2O通电
题目详情
某工厂用电解饱和食盐水方法生产氯气、烧碱、氢气等化工产品,这种工业称为“氯碱工业”. (反应的化学方程式:2NaCl+2H2O
2NaOH+H2↑+Cl2↑),某研究性学习小组对该厂生产的烧碱样品进行如下探究.
Ⅰ.定性探究
【提出问题】烧碱样品中可能含有哪些杂质?
【猜 想】一:可能含有Na2CO3,作出此猜想的依据是___ (用化学方程式表示).
二:可能含有NaCl,作出此猜想的依据是___(用简洁的文字表述).
【设计实验】
【交流与讨论 小明同学提出:“上述实验中稀硝酸也可以用稀盐酸代替”.你认为他的观点
___(填“正确”或“不正确”).
Ⅱ.定量探究
【提出问题】如何测定烧碱样品中氢氧化钠的质量分数呢?
【设计实验】小婉同学设计探究方案后进行实验并测得数据如下:
【实验一】取烧碱样品20g,加足量稀盐酸,称量反应前后D装置的质量增重0.22g;
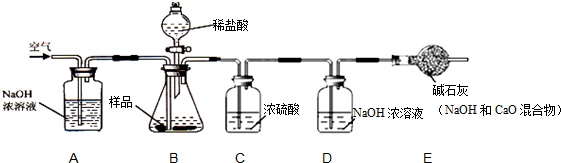
根据实验过程回答下列问题:
(1)装置B中发生反应的化学方程式___,___;
(2)实验过程中需持续缓缓通入空气,其作用有:
①搅拌B、C 中的反应物,使其充分反应;②___;
(3)装置C的作用是___;若没有E装置,则测得样品中杂质的质量分数___(填“偏大”、“偏小”或“不变”).
【实验二】取烧碱样品20g加水充分溶解,加足量AgNO3溶液和稀HNO3,过滤、洗涤、干燥,称量生成2.87g白色滤渣.
请你利用小婉同学测得的实验数据.
| ||
Ⅰ.定性探究
【提出问题】烧碱样品中可能含有哪些杂质?
【猜 想】一:可能含有Na2CO3,作出此猜想的依据是___ (用化学方程式表示).
二:可能含有NaCl,作出此猜想的依据是___(用简洁的文字表述).
【设计实验】
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁 | 试管外壁发热 | 原因是: ___. ___ |
| ②向①所得的溶液中逐滴加入稀硝酸至过量 | 开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体 | 样品中含有的杂质是 ___. |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生 ___现象 | 样品中还含有的杂质是NaCl. |
___(填“正确”或“不正确”).
Ⅱ.定量探究
【提出问题】如何测定烧碱样品中氢氧化钠的质量分数呢?
【设计实验】小婉同学设计探究方案后进行实验并测得数据如下:
【实验一】取烧碱样品20g,加足量稀盐酸,称量反应前后D装置的质量增重0.22g;

根据实验过程回答下列问题:
(1)装置B中发生反应的化学方程式___,___;
(2)实验过程中需持续缓缓通入空气,其作用有:
①搅拌B、C 中的反应物,使其充分反应;②___;
(3)装置C的作用是___;若没有E装置,则测得样品中杂质的质量分数___(填“偏大”、“偏小”或“不变”).
【实验二】取烧碱样品20g加水充分溶解,加足量AgNO3溶液和稀HNO3,过滤、洗涤、干燥,称量生成2.87g白色滤渣.
请你利用小婉同学测得的实验数据.
▼优质解答
答案和解析
【猜 想】一:二氧化碳与氢氧化钠反应生成碳酸钠和水,因此可能有碳酸钠,反应的化学方程式为CO2+2NaOH═Na2CO3+H2O;故答案为:CO2+2NaOH═Na2CO3+H2O;
二:氯化钠可能没有全部反应,因此可能有氯化钠;故填:可能有少量的氯化钠没有反应;
【设计实验】
加水溶解,试管外壁发热,原因是氢氧化钠固体溶于水放热;向①所得的溶液中逐渐加入稀硝酸至过量,一开始无明显现象,一段时间后产生能使澄清石灰水浑浊的气体,因此样品中含有的杂质是碳酸钠;向②所得的溶液中滴加几滴硝酸银溶液,产生白色沉淀氯化银,说明样品中还含有的杂质是氯化钠;上述实验中稀硝酸不可以用稀盐酸代替,因为盐酸中有氯离子,影响氯化钠中氯离子的检验.
故答案为:氢氧化钠固体溶于水放热;Na2CO3;白色沉淀;不正确;
Ⅱ.定量探究(1)盐酸和氢氧化钠反应生成氯化钠和水,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式分别为NaOH+HCl═NaCl+H2O、Na2CO3+2HCl═2NaCl+H2O+CO2↑;故填:NaOH+HCl═NaCl+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)实验过程中需持续缓缓通入空气,其作用有:①搅拌B、C 中的反应物,使其充分反应;②使生成的二氧化碳全部进入D装置;故填:使生成的二氧化碳全部进入D装置;
(3)浓硫酸具有吸水性,所以装置C的作用是除去水蒸气;若没有E装置,则空气中的二氧化碳会进入D装置,使测得样品中杂质的质量分数偏大;故填:除去水蒸气;偏大;
【实验二】设20g样品中含有碳酸钠的质量为x,氯化钠的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 0.22g
=
x=0.53g
NaCl+AgNO3═AgCl↓+NaNO3
58.5 143.5
y 2.87g
=
y=1.17g
氢氧化钠的质量分数=
×100%=91.5%
答:氢氧化钠的质量分数是91.5%.
二:氯化钠可能没有全部反应,因此可能有氯化钠;故填:可能有少量的氯化钠没有反应;
【设计实验】
加水溶解,试管外壁发热,原因是氢氧化钠固体溶于水放热;向①所得的溶液中逐渐加入稀硝酸至过量,一开始无明显现象,一段时间后产生能使澄清石灰水浑浊的气体,因此样品中含有的杂质是碳酸钠;向②所得的溶液中滴加几滴硝酸银溶液,产生白色沉淀氯化银,说明样品中还含有的杂质是氯化钠;上述实验中稀硝酸不可以用稀盐酸代替,因为盐酸中有氯离子,影响氯化钠中氯离子的检验.
故答案为:氢氧化钠固体溶于水放热;Na2CO3;白色沉淀;不正确;
Ⅱ.定量探究(1)盐酸和氢氧化钠反应生成氯化钠和水,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式分别为NaOH+HCl═NaCl+H2O、Na2CO3+2HCl═2NaCl+H2O+CO2↑;故填:NaOH+HCl═NaCl+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)实验过程中需持续缓缓通入空气,其作用有:①搅拌B、C 中的反应物,使其充分反应;②使生成的二氧化碳全部进入D装置;故填:使生成的二氧化碳全部进入D装置;
(3)浓硫酸具有吸水性,所以装置C的作用是除去水蒸气;若没有E装置,则空气中的二氧化碳会进入D装置,使测得样品中杂质的质量分数偏大;故填:除去水蒸气;偏大;
【实验二】设20g样品中含有碳酸钠的质量为x,氯化钠的质量为y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 0.22g
| 106 |
| x |
| 44 |
| 0.22g |
x=0.53g
NaCl+AgNO3═AgCl↓+NaNO3
58.5 143.5
y 2.87g
| 58.5 |
| y |
| 143.5 |
| 2.87g |
y=1.17g
氢氧化钠的质量分数=
| 20g-0.53g-1.17g |
| 20g |
答:氢氧化钠的质量分数是91.5%.
看了 某工厂用电解饱和食盐水方法生...的网友还看了以下:
写出下列反应的化学方程式,标出电子转移的方向和数目,并指出氯气在反应中表现出什么性质.(1)氢气在 2020-04-07 …
实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为MnO2+4HCl=MnCl2+C 2020-05-15 …
实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为MnO2+4HCl=MnCl2+C 2020-05-15 …
关于化学反应Cl2+KOH==KCl+KClO3+KClO的问题.化学反应Cl2+KOH==KCl 2020-05-17 …
几个化学反应方程式你写得出么?1,白磷和氢氧化钾反应2,氢氧化镁和饱和氯化胺反应3,重铬酸钾和氯化 2020-06-22 …
化学题(关于氯化氢)被同学带坏了呃~~~氯化氢溶于水是盐酸.还是氯化氢和水反应生成盐酸.将氢气置于 2020-07-15 …
某同学观察了如图所示的实验后,得出以下结论,你认为其中不合理的是()A.氯化氢分子和氨分子是不断运 2020-07-22 …
求教各位化学高手..!配方200毫升水的40%甲胺盐酸,为HCl反应氯化钠,为HCl反应用于冷却的1 2020-11-29 …
氯气用途广泛,某中学化学兴趣小组设计了制备氯气并进行一系列相关实验的装置(夹持设备已略).(1)制备 2020-12-19 …
如图是钠与氯气(Cl2)反应生成氯化钠的模拟图.下列说法不正确的是()A.反应中钠原子转移一个电子给 2020-12-31 …