早教吧作业答案频道 -->化学-->
某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4.为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据下列流程图,完成回收硫酸亚铁和铜的实验方案
题目详情
某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4.为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据下列流程图,完成回收硫酸亚铁和铜的实验方案.(可供选择的试剂为铁粉、稀H2SO4、NaOH溶液等试剂)
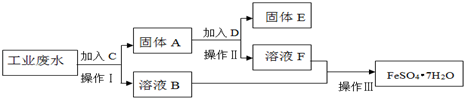
(1)操作Ⅰ的名称为___,所需要的玻璃仪器有___;
(2)固体A的成分为___,溶液B中含有的离子有___
(3)加入试剂C的目的是___,发生的化学方程式为___;
(4)加入的试剂D为___,发生的离子方程式为___;
(5)操作Ⅲ为___.

(1)操作Ⅰ的名称为___,所需要的玻璃仪器有___;
(2)固体A的成分为___,溶液B中含有的离子有___
(3)加入试剂C的目的是___,发生的化学方程式为___;
(4)加入的试剂D为___,发生的离子方程式为___;
(5)操作Ⅲ为___.
▼优质解答
答案和解析
先向工业废水中加过量铁,将铜全部置换出来,过滤得到固体A,其成分是铜和过量的铁,溶液B中含FeSO4和少量Na2SO4;向固体A中加入过量稀H2SO4,只有铁溶解,过滤得到固体E(铜),实现了回收金属铜,溶液F含FeSO4、H2SO4;最后溶液B和F合一块,进行蒸发,浓缩,冷却结晶,过滤,就得到FeSO4•7H2O,回收硫酸亚铁,
(1)操作Ⅰ为过滤,用于分离固体和液体,用到的玻璃仪器有漏斗、玻璃棒、烧杯,
故答案为:过滤;漏斗、玻璃棒、烧杯;
(2)加入过量的铁,铁与硫酸铜反应生成硫酸亚铁和铜,过滤得到固体A,其成分是铜和过量的铁,溶液B中含FeSO4和少量Na2SO4,则溶液B中含有的离子有:Fe2+、Na+、SO42-,
故答案为:Fe、Cu;Fe2+、Na+、SO42-;
(3)加过量铁,将Cu2+全部转化为Cu,以便回收铜单质,发生的化学方程式为:Fe+CuSO4=FeSO4+Cu,
故答案为:将Cu2+全部转化为Cu,以便回收铜单质;Fe+CuSO4=FeSO4+Cu;
(4)固体A的成分是铜和过量的铁,向固体A中加入过量D为稀H2SO4,目的是将铁溶解,把铜和铁分开,发生反应的离子方程式为:2H++Fe=Fe2++H2↑,
故答案为:稀硫酸;2H++Fe=Fe2++H2↑;
(5)从溶液B和溶液F中得到FeSO4.7H2O晶体的操作为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(1)操作Ⅰ为过滤,用于分离固体和液体,用到的玻璃仪器有漏斗、玻璃棒、烧杯,
故答案为:过滤;漏斗、玻璃棒、烧杯;
(2)加入过量的铁,铁与硫酸铜反应生成硫酸亚铁和铜,过滤得到固体A,其成分是铜和过量的铁,溶液B中含FeSO4和少量Na2SO4,则溶液B中含有的离子有:Fe2+、Na+、SO42-,
故答案为:Fe、Cu;Fe2+、Na+、SO42-;
(3)加过量铁,将Cu2+全部转化为Cu,以便回收铜单质,发生的化学方程式为:Fe+CuSO4=FeSO4+Cu,
故答案为:将Cu2+全部转化为Cu,以便回收铜单质;Fe+CuSO4=FeSO4+Cu;
(4)固体A的成分是铜和过量的铁,向固体A中加入过量D为稀H2SO4,目的是将铁溶解,把铜和铁分开,发生反应的离子方程式为:2H++Fe=Fe2++H2↑,
故答案为:稀硫酸;2H++Fe=Fe2++H2↑;
(5)从溶液B和溶液F中得到FeSO4.7H2O晶体的操作为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
看了某工厂的工业废水中含有大量的F...的网友还看了以下:
100个和尚,100个面包,大和尚每人吃4个,中和尚每人吃2个,小和尚4人吃一个,共各多少和尚各吃几 2020-03-30 …
英语翻译您的回答和意见将会对我们对这个方案的进程和对交通运输方式的计划很有帮助,因为我们的方案将在 2020-05-15 …
求解单位向量怎么求我看见书上说a0=a/a的模,但是我发现有些答案有点不同比如(3,-4)答案是( 2020-05-17 …
各位数学高手,帮我解下这几道题,谢谢~这几题只要最后答案:(1)-(a^5)^4÷(a^2)^3( 2020-05-21 …
关于五带的划分,下列说法正确的是:1.热带和温带的分界线:回归线2.温带和寒带的分界线:回归线3. 2020-05-22 …
判断对错.9分之4乘2和2乘9分之4的答案相同,意义不同.9分之4也可以写成4分之9.法则和定律是 2020-06-05 …
刚做完第一单元集合,就是书上本章回顾的复习题,17页的.请问一下第2题的答案,第7题的答案,和第十 2020-06-05 …
六一儿童节,商店搞促销活动,一本笔记本每本要6元,买4本送一本,明明买回30笨,共便宜多少钱,求答 2020-07-08 …
初一年纪的4个小题我需要答案和过程,急需一定会采纳你的!坐等答案!1、-2×3×(-4)2、-6× 2020-07-13 …
所有的都要列算式,算式只要加减乘除,可以有小括号和中括号:1.小马虎在算(4+□)×5的时候,一不留 2020-12-08 …