早教吧作业答案频道 -->化学-->
氨可用于制取氨水、液氮、氮肥(尿素、碳铵等)、硝酸、铵盐、纯碱等,因此被广泛应用于化工、轻工、化肥、制药、合成纤维、塑料等行业中,是重要的化工产品.(1)以甲烷为原料可
题目详情
氨可用于制取氨水、液氮、氮肥(尿素、碳铵等)、硝酸、铵盐、纯碱等,因此被广泛应用于化工、轻工、化肥、制药、合成纤维、塑料等行业中,是重要的化工产品.
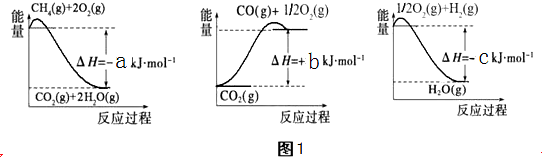
(1)以甲烷为原料可制得合成氨气用的氢气.有关化学反应的能量变化如图1所示.则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___.
(2)已知N2(g)+3H2⇌2NH3(g)△H=-94.4kJ•mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示.
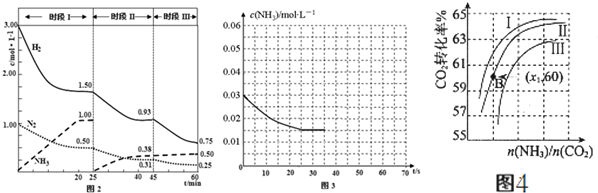
①25min时采取的措施是___.
②在实际制氨气工业生产中和该措施的目的相同的其它措施还有___.
(3)①CO可使合成氨的催化剂中毒而失去活性,因此工业上常用乙酸二氨合铜(I)溶液来吸收原料气体中的CO,反应原理:[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)⇌[Cu(NH3)3]CH3COO•CO(l)△H<0,吸收后的乙酸铜氨溶液经过适当处理后可再生而恢复其吸收CO的能力,则再生的适宜条件是___.(填字母序号).
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
②在一恒温恒容的密闭容器中,按照1:1充入一定物质的量的CO和NH3气体与足量的乙酸二氨合铜(I)溶液反应,容器中氨气的物质的量浓度随时间的变化如图3所示.若在35s时再充入原物质的量的CO和NH3气体后,请在图3中画出氨气的物质的量浓度随时间变化图.
(4)①用氨气制取尿素[CO(NH2)]的反应为2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(g)△H<0.某温度下,向容器为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%.则该反应的平衡常数K=___.
②在实际工业生产中,原料气带有水蒸气,图4表示CO2的转化率与氨碳比
、水碳比
的变化关系.
a、曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比(n(H2O)/n(CO2))最大的是___.
b、测得B点氨的转化率为40%,则x1=___.
(1)以甲烷为原料可制得合成氨气用的氢气.有关化学反应的能量变化如图1所示.则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___.

(2)已知N2(g)+3H2⇌2NH3(g)△H=-94.4kJ•mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图2所示.

①25min时采取的措施是___.
②在实际制氨气工业生产中和该措施的目的相同的其它措施还有___.
(3)①CO可使合成氨的催化剂中毒而失去活性,因此工业上常用乙酸二氨合铜(I)溶液来吸收原料气体中的CO,反应原理:[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)⇌[Cu(NH3)3]CH3COO•CO(l)△H<0,吸收后的乙酸铜氨溶液经过适当处理后可再生而恢复其吸收CO的能力,则再生的适宜条件是___.(填字母序号).
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
②在一恒温恒容的密闭容器中,按照1:1充入一定物质的量的CO和NH3气体与足量的乙酸二氨合铜(I)溶液反应,容器中氨气的物质的量浓度随时间的变化如图3所示.若在35s时再充入原物质的量的CO和NH3气体后,请在图3中画出氨气的物质的量浓度随时间变化图.
(4)①用氨气制取尿素[CO(NH2)]的反应为2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(g)△H<0.某温度下,向容器为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%.则该反应的平衡常数K=___.
②在实际工业生产中,原料气带有水蒸气,图4表示CO2的转化率与氨碳比
| n(NH3) |
| n(CO2) |
| n(H2O) |
| n(CO2) |
a、曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比(n(H2O)/n(CO2))最大的是___.
b、测得B点氨的转化率为40%,则x1=___.
▼优质解答
答案和解析
(1)图象分析反应过程都是能量降低的过程,反应的热化学方程式为:
①CO(g)+
O2(g)=CO2(g)△H=+bKJ/mol
②H2(g)+
O2(g)=H2O(g)△H=-cKJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-bKJ/mol
由盖斯定律③-②×3-①得到:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=-(a+b-3C) kJ.mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=-(a+b-3C) kJ.mol-1;
(2)①25min时氨气的物质的量迅速变为0而氮气、氢气的物质的量不变,之后氮气、氢气的物质的量逐渐减小,氨气的物质的量逐渐增大,说明25min时将NH3从反应体系中分离出去,
故答案为:将NH3从反应体系中分离出去;
②在实际制氨气工业生产中和该措施的目的相同的其它措施还有高压、原料气循环利用等方法,故答案为:高压、原料气循环利用等;
(3)①吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,依据化学平衡[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)⇌[Cu(NH3)3]CH3COO•CO(l);△H<0,反应是气体体积减小的放热反应,平衡逆向进行是再生的原理,再生的适宜条件是高温低压,
故答案为:B;
②若反应延续至70s,保持其它条件不变情况下,使用催化剂时,改变反应速率,不改变化学平衡,曲线的转折点在横坐标40之前,纵坐标必需在20的线上,该反应的进程曲线为如图所示: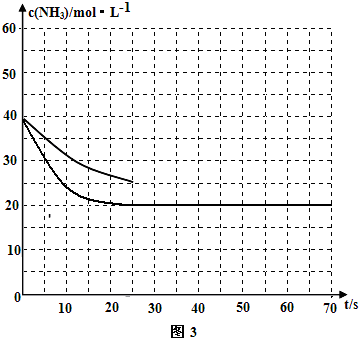 ,
,
故答案为: ;
;
(4)①某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%,转化的二氧化碳为1mol,则:
2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(g)
起始量(mol):4 2 0
变化量(mol):2 1 1
平衡量(mol):2 1 1
则平衡常数K=
=
=2500L2•mol-2,
故答案为:2500;
②a、氨碳比相同时曲线Ⅰ二氧化碳的转化率大,所以生产中选用水碳比的数值为Ⅲ,故答案为:Ⅲ;
b、由题意可知:2NH3(g)+CO2(g)⇌CO(NH2)2+H2O(g)
起始量 x1 1
变化量 2a a
即:
=40%,
=60%,则x1=3,
故答案为:3.
①CO(g)+
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-bKJ/mol
由盖斯定律③-②×3-①得到:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=-(a+b-3C) kJ.mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=-(a+b-3C) kJ.mol-1;
(2)①25min时氨气的物质的量迅速变为0而氮气、氢气的物质的量不变,之后氮气、氢气的物质的量逐渐减小,氨气的物质的量逐渐增大,说明25min时将NH3从反应体系中分离出去,
故答案为:将NH3从反应体系中分离出去;
②在实际制氨气工业生产中和该措施的目的相同的其它措施还有高压、原料气循环利用等方法,故答案为:高压、原料气循环利用等;
(3)①吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,依据化学平衡[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)⇌[Cu(NH3)3]CH3COO•CO(l);△H<0,反应是气体体积减小的放热反应,平衡逆向进行是再生的原理,再生的适宜条件是高温低压,
故答案为:B;
②若反应延续至70s,保持其它条件不变情况下,使用催化剂时,改变反应速率,不改变化学平衡,曲线的转折点在横坐标40之前,纵坐标必需在20的线上,该反应的进程曲线为如图所示:
 ,
,故答案为:
 ;
;(4)①某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%,转化的二氧化碳为1mol,则:
2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(g)
起始量(mol):4 2 0
变化量(mol):2 1 1
平衡量(mol):2 1 1
则平衡常数K=
| c(H2O) |
| c2(NH3)×c(CO2) |
| ||||
(
|
故答案为:2500;
②a、氨碳比相同时曲线Ⅰ二氧化碳的转化率大,所以生产中选用水碳比的数值为Ⅲ,故答案为:Ⅲ;
b、由题意可知:2NH3(g)+CO2(g)⇌CO(NH2)2+H2O(g)
起始量 x1 1
变化量 2a a
即:
| 2a |
| x1 |
| a |
| 1 |
故答案为:3.
看了氨可用于制取氨水、液氮、氮肥(...的网友还看了以下:
有关广西工农业和交通的叙述,错误的是()A.广西的粮食作物以水稻为主B.北海、防城港、钦州等是广西 2020-05-16 …
(2009•厦门二模)第四周期元素的单质及化合物在工农业生产中应用广泛.(1)第四周期元素中,基态 2020-07-01 …
第四周期元素的单质及化合物在工农业生产中应用广泛.(1)第四周期元素中,基态原子的最外层只有1个电 2020-07-01 …
硼元素、钙元素、铜元素在化学中有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.(1 2020-07-05 …
硼元素、钙元素、铜元素在化学战有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.(1 2020-07-29 …
三聚氰胺(化学式为C3H6N6)是一种白色结晶粉末,无气味,低毒,对人体有着某种危害作用,在有机化工 2020-10-31 …
近年来,郑州宇通客车股份有限公司牢固树立全心全意依靠员工办企业的理念,维护职工权益,建立学习型组织, 2020-11-12 …
过氧化物在日常生活与工农业生产中应用广泛。如:过氧化氢是一种常见的绿色氧化剂,过氧碳酸钠、过氧化尿素 2020-11-22 …
广东省的电子、轻工业产品与通讯设备完善,加工钢铁、装备与化工产业快速发展,现在广东省汽车出口量正式跃 2020-12-23 …
工业革命完成的标志是()A.大机器的推广B.交通运输工具的革新C.大机器生产基本取代工场手工业D.工 2021-02-01 …