早教吧作业答案频道 -->化学-->
ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得.无水草酸100℃可以升华.某学习小组用图1装置模拟工业制取收集ClO2.(1)实验时装置A需在60℃~100℃进
题目详情
ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得.无水草酸100℃可以升华.某学习小组用图1装置模拟工业制取收集ClO2.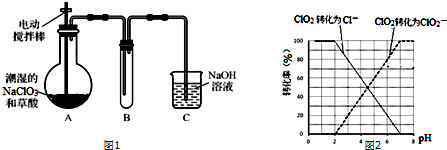
(1)实验时装置A需在60℃~100℃进行的原因是___,控制所需温度的方法是___.
(2)电动搅拌棒的作用是___.装置A中反应产物有Na2CO3、ClO2和CO2等,该反应的化学方程式为___.
(3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2,写出反应的离子方程式___.
(4)用ClO2处理过的饮用水(pH为5.5~6.5)往往残留少量ClO2和一定量对人体不利的亚氯酸根离子(ClO2-).
①ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图2所示
②当pH≤2.0时,ClO2-也能被I-还原成Cl-
③2Na2S2O3+I2=Na2S4O6+2NaI
根据上述信息,请补充完整测定饮用水中ClO2-含量的实验方案:
取一定体积的饮用水,加入NaOH溶液调节pH为7.0~8.0;___;再重复上述操作1~2次,计算得出结果.
(实验中需使用的试剂:淀粉溶液、标准Na2S2O3溶液、KI溶液、稀硫酸)

(1)实验时装置A需在60℃~100℃进行的原因是___,控制所需温度的方法是___.
(2)电动搅拌棒的作用是___.装置A中反应产物有Na2CO3、ClO2和CO2等,该反应的化学方程式为___.
(3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2,写出反应的离子方程式___.
(4)用ClO2处理过的饮用水(pH为5.5~6.5)往往残留少量ClO2和一定量对人体不利的亚氯酸根离子(ClO2-).
①ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图2所示
②当pH≤2.0时,ClO2-也能被I-还原成Cl-
③2Na2S2O3+I2=Na2S4O6+2NaI
根据上述信息,请补充完整测定饮用水中ClO2-含量的实验方案:
取一定体积的饮用水,加入NaOH溶液调节pH为7.0~8.0;___;再重复上述操作1~2次,计算得出结果.
(实验中需使用的试剂:淀粉溶液、标准Na2S2O3溶液、KI溶液、稀硫酸)
▼优质解答
答案和解析
(1)一般来说,升高温度,活化分子的百分数增大,反应速率增大,温度过低,化学反应速率较慢,无水草酸100℃可以升华,温度过高草酸升华或分解,所以实验时装置A需在60℃~100℃进行,反应温度低于水的沸点,用水浴可使反应容器受热均匀,所以反应要用水浴加热,
故答案为:温度过低,化学反应速率较慢,温度过高草酸升华或分解;水浴加热;
(2)实验时电动搅拌,能增加反应物的接触机会,将反应物充分混合(或充分反应、或使反应物受热均匀),使反应速率加快,装置A中反应物为NaClO3、H2C2O4,产物有Na2CO3、ClO2和CO2等,Cl(+5→+4),C(+3→+4),根据得失电子守恒和原子守恒,该反应方程式为:2NaClO3+H2C2O4
Na2CO3+CO2↑+2ClO2↑+H2O,
故答案为:将反应物充分混合(或充分反应、或使反应物受热均匀);2NaClO3+H2C2O4
Na2CO3+CO2↑+2ClO2↑+H2O;
(3)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,氧化还原反应规律,另一种离子中Cl元素化合价升高,即为ClO3-,反应的离子方程式为:2ClO2+2OH-=ClO3-+ClO2-+H2O,
故答案为:2ClO2+2OH-=ClO3-+ClO2-+H2O;
(4)信息③用Na2S2O3溶液滴定至终点,说明步骤中有碘生成,是用连续碘量法进行测定,根据曲线图示在pH≤2.0时,ClO2被I-还原只生成Cl-,pH≥7.0时,ClO2被I-还原只生成ClO2-;而用ClO2处理过的饮用水,其pH为5.5~6.5,所以其中既含有ClO2,又含有ClO2-,若将溶液的pH调节为7.0~8.0,则第一阶段滴定时只是ClO2被I-还原只生成ClO2-,溶液的ClO2-没有被I-还原,所以第二阶段滴定前应调节溶液的pH≤2.0,使ClO2-与I-反应,以测定样品水样中亚氯酸根离子的含量,所以需调节溶液的pH≤2.0,所以测定饮用水中ClO2-含量的实验方案为:加入足量KI溶液,加2滴淀粉溶液;用标准Na2S2O3溶液滴定至终点(或蓝色褪去),记录消耗标准Na2S2O3溶液的体积;加入稀硫酸调节溶液的pH≤2.0;继续用标准Na2S2O3溶液滴定至终点,记录消耗标准Na2S2O3溶液的体积,
故答案为:加入足量KI溶液,加2滴淀粉溶液;用标准Na2S2O3溶液滴定至终点(或蓝色褪去),记录消耗标准Na2S2O3溶液的体积;加入稀硫酸调节溶液的pH≤2.0;继续用标准Na2S2O3溶液滴定至终点,记录消耗标准Na2S2O3溶液的体积.
故答案为:温度过低,化学反应速率较慢,温度过高草酸升华或分解;水浴加热;
(2)实验时电动搅拌,能增加反应物的接触机会,将反应物充分混合(或充分反应、或使反应物受热均匀),使反应速率加快,装置A中反应物为NaClO3、H2C2O4,产物有Na2CO3、ClO2和CO2等,Cl(+5→+4),C(+3→+4),根据得失电子守恒和原子守恒,该反应方程式为:2NaClO3+H2C2O4
| ||
故答案为:将反应物充分混合(或充分反应、或使反应物受热均匀);2NaClO3+H2C2O4
| ||
(3)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,氧化还原反应规律,另一种离子中Cl元素化合价升高,即为ClO3-,反应的离子方程式为:2ClO2+2OH-=ClO3-+ClO2-+H2O,
故答案为:2ClO2+2OH-=ClO3-+ClO2-+H2O;
(4)信息③用Na2S2O3溶液滴定至终点,说明步骤中有碘生成,是用连续碘量法进行测定,根据曲线图示在pH≤2.0时,ClO2被I-还原只生成Cl-,pH≥7.0时,ClO2被I-还原只生成ClO2-;而用ClO2处理过的饮用水,其pH为5.5~6.5,所以其中既含有ClO2,又含有ClO2-,若将溶液的pH调节为7.0~8.0,则第一阶段滴定时只是ClO2被I-还原只生成ClO2-,溶液的ClO2-没有被I-还原,所以第二阶段滴定前应调节溶液的pH≤2.0,使ClO2-与I-反应,以测定样品水样中亚氯酸根离子的含量,所以需调节溶液的pH≤2.0,所以测定饮用水中ClO2-含量的实验方案为:加入足量KI溶液,加2滴淀粉溶液;用标准Na2S2O3溶液滴定至终点(或蓝色褪去),记录消耗标准Na2S2O3溶液的体积;加入稀硫酸调节溶液的pH≤2.0;继续用标准Na2S2O3溶液滴定至终点,记录消耗标准Na2S2O3溶液的体积,
故答案为:加入足量KI溶液,加2滴淀粉溶液;用标准Na2S2O3溶液滴定至终点(或蓝色褪去),记录消耗标准Na2S2O3溶液的体积;加入稀硫酸调节溶液的pH≤2.0;继续用标准Na2S2O3溶液滴定至终点,记录消耗标准Na2S2O3溶液的体积.
看了ClO2气体是一种高效、广谱、...的网友还看了以下:
为了检验抵抗某种疾病的疫苗对某种鸟类是否有效,下列对实验程序的叙述,最恰当的是()A.给100只鸟 2020-05-17 …
下面是菜豆种子的结构及其萌发后的幼苗示意图,请据图回答:(1)幼苗的A是由种子的发育来的,C是由种 2020-05-17 …
水土保持草草种选择的要求是什么?并举例说出适合西北地区的草种? 2020-05-28 …
(2014•黄石)某校九(3)班去大冶茗山乡花卉基地参加社会实践活动,该基地有玫瑰花和蓑衣草两种花 2020-06-11 …
我国栽培的牧草有4000种,牧草种数和栽培的药用植物种数的比是4比11.栽培的药用我国栽培的牧草有 2020-06-19 …
对农民来讲,农作物的种子中混有一些杂草的种子是一件很头痛的事情,但是这两种种子在外表上是不同的:农 2020-06-26 …
中草药文化有着数千年的悠久历史,底蕴丰厚。许多对联中巧妙地运用了中草药名,在给人以艺术享受的同时, 2020-07-02 …
某同学在实验室发现一没有瓶塞的试剂瓶,里面装有白色固体试剂,瓶上标签已经严重腐蚀,看不清上面的字迹, 2020-11-07 …
(2010•中山二模)某生在实验室发现一没有瓶塞的试剂瓶,里面装有白色固体试剂,瓶上标签已经严重腐蚀 2020-11-07 …
某生在实验室发现一没有瓶塞的试剂瓶,里面装有白色固体试剂,瓶上标签已经严重腐蚀,看不清上面的字迹,但 2020-12-02 …