早教吧作业答案频道 -->化学-->
某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).(1)关闭活塞a与b,将9.6gCu片和18mL18mol•L-1的浓H2SO4加入仪器B中共热至反应完全
题目详情
某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).
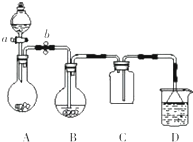
(1)关闭活塞a与b,将9.6g Cu片和18mL18mol•L-1的浓H2SO4加入仪器B中共热至反应完全,发现烧瓶中还有Cu片剩余.该小组学生根据所学化学知识认为还有一定量的硫酸剩余.
①写出仪器B中发生反应的化学方程式___.有一定量的H2SO4剩余但未能使铜片完全溶解,你认为可能的原因是___.
②请指出该套装置中的一个明显错误___.
③装置C中气休收集满后,移走装置C,将装置B与装置D对接,然后打开活塞a与b,将分液漏斗中的无色无味液体滴入到装置A中淡黄色固休的表面,产生的无色气体可使装置B中剩余Cu片继续溶解,写出此时仪器B中发生反应的化学方程式___.
(2)欲测定H2SO4浓度低于多少时反应停止.该小组学生重新用足量铜与一定量的浓H2SO4共热,反应停止后冷却,再测定余酸的物质的量浓度.甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度.他设计了几种测定SO2的量的方案,下列方案中不可行的是___(填写字母编号).
A、将装置B产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
B、将装置B产生的气体缓缓通入足量酸性KMnO4溶液.再加人足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C、用排水法测定装置B产生气体的体积(已折算成标准状况)
D、用排饱和NaHSO3溶液的方法测出装置B产生气体的体积(已折算成标准状况)
②乙学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20ml于锥形瓶中,滴入几滴甲基橙作指示剂,用标准NaOH溶液进行滴定,通过测出消耗NaOH溶液的体积来求余酸的物质的量的浓度.假定反应前后烧瓶中溶液的体积不变,你认为乙学生设计的实验方案能否求得余酸的物质的量的浓度___(填“能”或“否”).理由是___.
[已知:Cu(OH)2开始沉淀的pH约为5,甲基橙变色的pH值范围为3.1-4.4].

(1)关闭活塞a与b,将9.6g Cu片和18mL18mol•L-1的浓H2SO4加入仪器B中共热至反应完全,发现烧瓶中还有Cu片剩余.该小组学生根据所学化学知识认为还有一定量的硫酸剩余.
①写出仪器B中发生反应的化学方程式___.有一定量的H2SO4剩余但未能使铜片完全溶解,你认为可能的原因是___.
②请指出该套装置中的一个明显错误___.
③装置C中气休收集满后,移走装置C,将装置B与装置D对接,然后打开活塞a与b,将分液漏斗中的无色无味液体滴入到装置A中淡黄色固休的表面,产生的无色气体可使装置B中剩余Cu片继续溶解,写出此时仪器B中发生反应的化学方程式___.
(2)欲测定H2SO4浓度低于多少时反应停止.该小组学生重新用足量铜与一定量的浓H2SO4共热,反应停止后冷却,再测定余酸的物质的量浓度.甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度.他设计了几种测定SO2的量的方案,下列方案中不可行的是___(填写字母编号).
A、将装置B产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
B、将装置B产生的气体缓缓通入足量酸性KMnO4溶液.再加人足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C、用排水法测定装置B产生气体的体积(已折算成标准状况)
D、用排饱和NaHSO3溶液的方法测出装置B产生气体的体积(已折算成标准状况)
②乙学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20ml于锥形瓶中,滴入几滴甲基橙作指示剂,用标准NaOH溶液进行滴定,通过测出消耗NaOH溶液的体积来求余酸的物质的量的浓度.假定反应前后烧瓶中溶液的体积不变,你认为乙学生设计的实验方案能否求得余酸的物质的量的浓度___(填“能”或“否”).理由是___.
[已知:Cu(OH)2开始沉淀的pH约为5,甲基橙变色的pH值范围为3.1-4.4].
▼优质解答
答案和解析
(1)①试管Ⅰ中发生的反应是铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,Cu只能与浓硫酸在加热条件下反应,而与稀硫酸不反应,随着反应的进行,硫酸的浓度逐渐下降,最后剩余,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;随着反应的进行,浓硫酸逐渐变稀,水逐渐增多,稀硫酸和铜不反应,反应停止;
②装置C收集二氧化硫,装置D进行尾气处理,为防止倒吸,装置C中导管应该长进短出,
故答案为:装置C中导管应该长进短出;
③分液漏斗中的无色无味液体为水,滴入到装置A中淡黄色固体过氧化钠的表面,产生的无色气体为氧气,装置B中剩余Cu片继续溶解的原因为:2Cu+O2+2H2SO4=2CuSO4+2H2O,
故答案为:2Cu+O2+2H2SO4=2CuSO4+2H2O;
(2)①测定SO2的量必须准确测定无气体损耗,实验操作简单易行;
A、将装置产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量,由于气体中含有水蒸气,碱石灰会吸收二氧化硫和水蒸气,称量后计算不准确,故A不可行;
B、将装置A产生的气体缓缓通入足量的硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.过程中沉淀的质量是由二氧化硫被氧化生成的硫酸根离子和酸化高锰酸钾溶液中的硫酸根离子,所以测定不出二氧化硫的含量,故B不可行;
C、二氧化硫气体是易溶于水的物质,用排水法测定装置A产生气体的体积不准确,故C不可行;
D、用排饱和NaHSO3溶液的方法测出装置A产生气体的体积,二氧化硫在饱和NaHSO3溶液中 的溶解度降低,可以用排水量气方法进行二氧化硫的气体体积测定,故D可行;
故答案为:ABC;
②滴定实验测定物质的含量,需要做到准确量取液体的体积,用滴定管可以解决,准确判断反应的终点,测定余酸的物质的量浓度,用标准氢氧化钠溶液进行滴淀,因为在含有Cu2+、H+的混合溶液中,当以甲基橙为指示剂用标准氢氧化钠溶液进行滴定时,可以有效排除Cu2+干扰,准确测出H+的物质的量,[或“否”,虽然甲基橙变色范围:pH为3.1~4.4,氢氧化铜开始沉淀时的pH为5,在指示剂变色范围之外,即中和酸时,铜离子不会消耗OH-,但是甲基橙由红色变成橙色、黄色时,铜离子溶液呈蓝色,对观察指示终点颜色有干扰,不能指示反应的终点判断,所以不能通过测出消耗NaOH溶液的体积来求余酸的物质的量的浓度],
故答案为:“能”[或“否”];因为在含有Cu2+、H+的混合溶液中,当以甲基橙为指示剂用标准氢氧化钠溶液进行滴定时,可以有效排除Cu2+干扰,准确测出H+的物质的量[不能;铜离子溶液呈蓝色会干扰滴定终点的正确判断].
| ||
故答案为:Cu+2H2SO4(浓)
| ||
②装置C收集二氧化硫,装置D进行尾气处理,为防止倒吸,装置C中导管应该长进短出,
故答案为:装置C中导管应该长进短出;
③分液漏斗中的无色无味液体为水,滴入到装置A中淡黄色固体过氧化钠的表面,产生的无色气体为氧气,装置B中剩余Cu片继续溶解的原因为:2Cu+O2+2H2SO4=2CuSO4+2H2O,
故答案为:2Cu+O2+2H2SO4=2CuSO4+2H2O;
(2)①测定SO2的量必须准确测定无气体损耗,实验操作简单易行;
A、将装置产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量,由于气体中含有水蒸气,碱石灰会吸收二氧化硫和水蒸气,称量后计算不准确,故A不可行;
B、将装置A产生的气体缓缓通入足量的硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.过程中沉淀的质量是由二氧化硫被氧化生成的硫酸根离子和酸化高锰酸钾溶液中的硫酸根离子,所以测定不出二氧化硫的含量,故B不可行;
C、二氧化硫气体是易溶于水的物质,用排水法测定装置A产生气体的体积不准确,故C不可行;
D、用排饱和NaHSO3溶液的方法测出装置A产生气体的体积,二氧化硫在饱和NaHSO3溶液中 的溶解度降低,可以用排水量气方法进行二氧化硫的气体体积测定,故D可行;
故答案为:ABC;
②滴定实验测定物质的含量,需要做到准确量取液体的体积,用滴定管可以解决,准确判断反应的终点,测定余酸的物质的量浓度,用标准氢氧化钠溶液进行滴淀,因为在含有Cu2+、H+的混合溶液中,当以甲基橙为指示剂用标准氢氧化钠溶液进行滴定时,可以有效排除Cu2+干扰,准确测出H+的物质的量,[或“否”,虽然甲基橙变色范围:pH为3.1~4.4,氢氧化铜开始沉淀时的pH为5,在指示剂变色范围之外,即中和酸时,铜离子不会消耗OH-,但是甲基橙由红色变成橙色、黄色时,铜离子溶液呈蓝色,对观察指示终点颜色有干扰,不能指示反应的终点判断,所以不能通过测出消耗NaOH溶液的体积来求余酸的物质的量的浓度],
故答案为:“能”[或“否”];因为在含有Cu2+、H+的混合溶液中,当以甲基橙为指示剂用标准氢氧化钠溶液进行滴定时,可以有效排除Cu2+干扰,准确测出H+的物质的量[不能;铜离子溶液呈蓝色会干扰滴定终点的正确判断].
看了某化学小组设计了如图所示装置....的网友还看了以下:
matlab求解积分方程求问上图,a=50,b=1,c=29,e=10.u是服从于N(645.25 2020-05-16 …
数理统计学,总体均值估计中,大样本方法时U是什么书上说因为平均数近似服从正态分布N(μ,σ²/n) 2020-06-10 …
期望的性质:E(AX)=AEX,E(X+a)=EX+a,那么E(X^2)是什么?以正态分布为例正态 2020-06-10 …
一电子经加速电场加速后,垂直射入一匀强磁场区域,如图所示,电子从磁场边界射出时的偏角θ随加速电压U 2020-07-08 …
设全集为U,集合A⊆U、B⊆U,则下列关系中与A⊆B等价的是.(写出你认为正确的所有序号)(1)A 2020-08-02 …
如图所示的U-I图线上,a、b、c各点均表示该电路中有一个确定的工作状态,b点α=β,则下列说法中正 2020-11-24 …
如图所示U-I图线上a、b、c各点均表示该电路中有一个确定的工作状态,b点α=β,则下列说法中正确的 2020-11-24 …
如图所示,U-I图线上,a、b、c各点均表示该电路中有一个确定的工作状态,b点α=β,则下列说法中正 2020-11-24 …
如图所示U-I图线上a、b、c各点均表示该电路中有一个确定的工作状态,b点α=β,则下列说法中正确的 2020-11-24 …
a:A交B=U(全集)b:A=U或B=Ua是b的充分非必要条件把b改成A=U且B=U那是充要吗?a: 2021-01-04 …