研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)ΔH1=+489.0kJ·mol-1,
研究和深度开发 CO 、 CO 2 的应用对构建生态文明社会具有重要的意义。
(1) CO 可用于炼铁,已知: Fe 2 O 3 (s) + 3C (s) = 2Fe (s) + 3CO(g) Δ H 1 =+ 489.0 kJ· mol - 1 ,
C(s) + CO 2 (g) = 2CO(g) Δ H 2 =+ 172.5 kJ·mol - 1 , 则 CO 还原 Fe 2 O 3 (s) 的热化学方程式为 。
(2)CO 与 O 2 设计成燃料电池 ( 以 KOH 溶液为电解液 ) 。该电池的负极反应式为 。
(3)CO 2 和 H 2 充入一定体积的恒容密闭容器中,在两种温度下发生反应: CO 2 (g) + 3H 2 (g) ![]() CH 3 OH(g) + H 2 O(g) 测得 CH 3 OH 的物质的量随时间的变化如图 5 。
CH 3 OH(g) + H 2 O(g) 测得 CH 3 OH 的物质的量随时间的变化如图 5 。
|

① 该反应的 Δ H 0( 填 “ 大于或小于 ”) ,曲线 I 、 Ⅱ 对应的平衡常数大小关系为
K Ⅰ K Ⅱ ( 填 “ >、=或< ”) 。
② 一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1 mol CO 2 、 3 mol H 2 | a molCO 2 、 3a molH 2 、 b molCH 3 OH(g) 、 b molH 2 O(g) |
若甲中平衡后气体的压强为开始的 0.8 倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则 b 的取值范围为 。
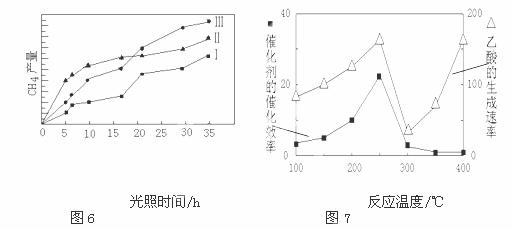
(4) 利用光能和光催化剂,可将 CO 2 和 H 2 O(g) 转化为 CH 4 和 O 2 。紫外光照射时,在不同催化剂 (I 、 II 、 III) 作用下, CH 4 产量随光照时间的变化如图 6 。在 0 ~ 15 小时内, CH 4 的平均生成速率 I 、 II 和 III 从小到大的顺序为 ( 填序号 ) 。
(5) 以 TiO 2 /Cu 2 Al 2 O 4 为催化剂 , 可以将 CO 2 和 CH 4 直接转化成乙酸。
在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图 7 。
① 当温度在 范围时,温度是乙酸生成速率的主要影响因素。
②Cu 2 Al 2 O 4 可溶于稀硝酸,稀硝酸还原产物为NO,写出有关的离子方程式 。
【答案】 (1) Fe 2 O 3 (s)+ 3CO(g) = 2Fe(s)+ 3CO 2 (g) △ H =- 28.5 kJ·mol - 1
( 2 ) CO + 4OH - ― 2e - = CO 3 2 - + 2H 2 O ( 3 )①> < ② 0.4 < c≤1 ( 4 ) II > III > I
( 5 )① 300 ℃~ 400 ℃ ② 3Cu 2 Al 2 O 4 +32H + +2NO 3 - = 6Cu 2+ + 6Al 3+ +2NO↑+16H 2 O
【解析】 (1) 根据盖斯定律,热化学方程式①-② ×3 ,得出 Fe 2 O 3 (s)+ 3CO(g) = 2Fe(s)+ 3CO 2 (g) △ H =- 28.5 kJ·mol - 1
( 2 )负极失去电子, CO 为负极产生 CO 3 2 - ,氧气为正极,负极为 CO + 4OH - ― 2e - = CO 3 2 - + 2H 2 O
( 3 )①由图像判断Ⅱ温度高于 I ,但 I 甲醇物质的量多,温度高平衡正向移动,平衡常数大,正反应吸热;该反应的 Δ H >0 , K Ⅰ < K Ⅱ , ②平衡后物质的量为 4×0.8=3.2mol Δn=4 - 3.2=0.8mol CO 2 (g) +3H 2 (g)![]() CH 3 OH(g) +H 2 O(g) Δn=2
CH 3 OH(g) +H 2 O(g) Δn=2
起始量 1 3
转化量 0.4 1.2 0.4 0.4 0.8
平衡量 0.6 1.8 0.4 0.4
该反应与原反应等效平衡,为全等等效,即等效转化为反应物量相等,若保持平衡逆向移动,则 C>0.4 , C 最高为 1 ,所以 C 的取值范围为 0.4 < c≤1
(4) 由图Ⅱ可知, CH 4 的平均生成速率顺序为 II > III > I
( 5 )①从 300 ℃开始,催化剂对反应基本没有影响,温度升高,生成乙酸速率增大,所以 ① 当温度在 300 ℃~ 400 ℃范围时,温度是乙酸生成速率的主要影响因素;② Cu 2 Al 2 O 4 中铜为 +1 价,与硝酸反应被氧化为 +2 价,硝酸被还原为 NO 。反应的离子方程式为 3Cu 2 Al 2 O 4 +32H + +2NO 3 - = 6Cu 2+ + 6Al 3+ +2NO↑+16H 2 O 。
定义在R上的函数f(x),对任意x,y∈R,有f(x+y)+f(x-y)=2f(x)*f(y),且 2020-05-13 …
已知函数f(x)=a^(x+b),(a>o,a不等于1)满足f(x+y)=f(x)f(y),且f( 2020-06-03 …
(2014•玉林)如图的⊙O中,AB为直径,OC⊥AB,弦CD与OB交于点F,过点D、A分别作⊙O 2020-07-11 …
高一基础分段函数题两道(30)一,已知f(x)=X^2,X>0,1,X=0-2X+1,X<01,画 2020-07-20 …
已知集合A={1,2,3},B={-1,o,1}已知集合A={1,2,3},B={-1,0,1}, 2020-07-30 …
1.已知函数f(x)=x^3+x(x∈R)若a,b,c∈R,且a+b>0,b+c>0,a+c>0, 2020-07-30 …
已知f(x)=x+a/x+1,f(3)=2,则f(-3)=?已知a为第四象限角,cosa=3/5, 2020-08-03 …
已知f(x)=kx+b,且f(-1)=7,f(2)=-5,则f(3)=已知函数f(x)=x+1/x- 2020-10-31 …
已知f(x)=sin(ωx+π/6)(ω>o),f(π/6)=f(π/3),且f(x)在区间(π/1 2020-10-31 …
求解几道函数题已知函数F(X)=3X方-5X+2,求F(-根号2),F(-A),F(A+3),F(A 2020-12-31 …