早教吧作业答案频道 -->化学-->
运用化学原理知识研究化学对于人类的生产生活、科研意义重大.(1)工业上以黄铜矿(主要成分:CuFeS2,其中S为-2价)为原料,采用火法熔炼工艺生产粗铜.CuFeS2中Fe的化合价为,熔炼
题目详情
运用化学原理知识研究化学对于人类的生产生活、科研意义重大.
(1)工业上以黄铜矿(主要成分:CuFeS2,其中S为-2价)为原料,采用火法熔炼工艺生产粗铜.CuFeS2中Fe的化合价为___,熔炼过程中所得炉渣的主要成分有FeO、Fe2O3、SiO2,Al2O3等,若要利用炉渣制取铁红,下列实验操作不需要的是___(填写字母代号).
A.溶解 B.过滤 C.蒸发结晶 D.灼烧
(2)Mg(OH)2是水垢的主要成分之一,用氯化铵溶液浸泡:可以溶解Mg(OH)2,请结合沉淀溶解平衡移动原理解释其原因___.
(3)研究发现CuCl2溶液中铜、氯元素的存在形式为Cu(H2O)42+、CuCl42-,电解CuCl2溶液一段时间,阳极产生2.24L(标准状况)黄绿色气体,阴极析出红色物质,试计算该过程中共转移电子___mol,若要使电解质溶液恢复至原浓度,应向电解后的溶液中加入(填化学式及物质质量)___.
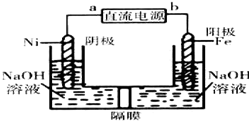
(4)Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂.电解法制备Na2FeO4的装置如图所示:
请根据图示回答:电解过程的化学方程式为___;电路中每通过0.6mol电子在Ni电极上产生的气体在标况下的体积为___.

(1)工业上以黄铜矿(主要成分:CuFeS2,其中S为-2价)为原料,采用火法熔炼工艺生产粗铜.CuFeS2中Fe的化合价为___,熔炼过程中所得炉渣的主要成分有FeO、Fe2O3、SiO2,Al2O3等,若要利用炉渣制取铁红,下列实验操作不需要的是___(填写字母代号).
A.溶解 B.过滤 C.蒸发结晶 D.灼烧
(2)Mg(OH)2是水垢的主要成分之一,用氯化铵溶液浸泡:可以溶解Mg(OH)2,请结合沉淀溶解平衡移动原理解释其原因___.
(3)研究发现CuCl2溶液中铜、氯元素的存在形式为Cu(H2O)42+、CuCl42-,电解CuCl2溶液一段时间,阳极产生2.24L(标准状况)黄绿色气体,阴极析出红色物质,试计算该过程中共转移电子___mol,若要使电解质溶液恢复至原浓度,应向电解后的溶液中加入(填化学式及物质质量)___.
(4)Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂.电解法制备Na2FeO4的装置如图所示:
请根据图示回答:电解过程的化学方程式为___;电路中每通过0.6mol电子在Ni电极上产生的气体在标况下的体积为___.
▼优质解答
答案和解析
(1)CuFeS2中Cu、Fe的化合价为+2价,S为-2价,
利用炉渣制取铁红,可加入氢氧化钠溶液除去SiO2,Al2O3,然后灼烧可得铁红,需要的操作为溶解、过滤、灼烧,不需要蒸发结晶,
故答案为:+2;C;
(2)溶液中存在氢氧化镁的溶解平衡Mg(OH)2(s)⇌Mg2+(aq)+2OH-(aq),电离出的氢氧根离子可与氯化铵电离出的铵根离子结合生成一水合氨,平衡右移,促进Mg(OH)2的溶解,
故答案为:溶液中存在Mg(OH)2(s)⇌Mg2+(aq)+2OH-(aq),加入氯化铵溶液浸泡时,发生NH4++OH-=NH3•H2O,平衡右移,促进Mg(OH)2的溶解;
(3)电解CuCl2溶液一段时间,阳极产生2.24L(标准状况)黄绿色气体,发生2Cl--2e-=Cl2↑,且n(Cl2)=
=0.1mol,转移0.2mol电子,
阴极析出红色物质,生成铜,电极方程式为Cu2++2e-=Cu,则阴极析出0.1molCu,质量为m(CuCl2)=0.1mol×135.5g/mol=13.5g,则若要使电解质溶液恢复至原浓度,应向电解后的溶液中加入13.5gCuCl2,
故答案为:0.2;13.5gCuCl2;
(4)利用电解法制备Na2FeO4,Fe作阳极,碱性条件下Fe失电子转化为FeO42-离子,阳极电极反应式为:Fe+8OH--6e-=FeO42-+4H2O,Ni为阴极,发生还原反应,氢离子放电生成氢气,阴极电极反应式为:6H2O+6e-=3H2↑+6OH-,所以电池反应式为:Fe+2OH-+2H2O
FeO42-+3H2↑;
根据电子转移守恒,生成氢气的物质的量为
=0.3mol,标况下氢气体积为0.3mol×22.4L/mol=6.72L;
故答案为:Fe+2OH-+2H2O
FeO42-+3H2↑;6.72L.
利用炉渣制取铁红,可加入氢氧化钠溶液除去SiO2,Al2O3,然后灼烧可得铁红,需要的操作为溶解、过滤、灼烧,不需要蒸发结晶,
故答案为:+2;C;
(2)溶液中存在氢氧化镁的溶解平衡Mg(OH)2(s)⇌Mg2+(aq)+2OH-(aq),电离出的氢氧根离子可与氯化铵电离出的铵根离子结合生成一水合氨,平衡右移,促进Mg(OH)2的溶解,
故答案为:溶液中存在Mg(OH)2(s)⇌Mg2+(aq)+2OH-(aq),加入氯化铵溶液浸泡时,发生NH4++OH-=NH3•H2O,平衡右移,促进Mg(OH)2的溶解;
(3)电解CuCl2溶液一段时间,阳极产生2.24L(标准状况)黄绿色气体,发生2Cl--2e-=Cl2↑,且n(Cl2)=
| 2.24L |
| 22.4L/mol |
阴极析出红色物质,生成铜,电极方程式为Cu2++2e-=Cu,则阴极析出0.1molCu,质量为m(CuCl2)=0.1mol×135.5g/mol=13.5g,则若要使电解质溶液恢复至原浓度,应向电解后的溶液中加入13.5gCuCl2,
故答案为:0.2;13.5gCuCl2;
(4)利用电解法制备Na2FeO4,Fe作阳极,碱性条件下Fe失电子转化为FeO42-离子,阳极电极反应式为:Fe+8OH--6e-=FeO42-+4H2O,Ni为阴极,发生还原反应,氢离子放电生成氢气,阴极电极反应式为:6H2O+6e-=3H2↑+6OH-,所以电池反应式为:Fe+2OH-+2H2O
| ||
根据电子转移守恒,生成氢气的物质的量为
| 0.6mol |
| 2 |
故答案为:Fe+2OH-+2H2O
| ||
看了运用化学原理知识研究化学对于人...的网友还看了以下:
水稻专业组有两块早稻田.一块450㎡,平均每平方米产1.3千米;另一块560平方米,平均每平方米产 2020-04-11 …
不等式应用题某饮料厂开发了A,B两种饮料,主要原料均为甲和乙.生产1瓶A饮料用20克甲,40克乙, 2020-05-16 …
随机数生成问题有一个随机数生成函数以等概率1/2产生数字1和2,问:(1)如何用它以等概率1/3产 2020-05-17 …
制造费用分配计算(要求怎么计算得来的数据需详细列出)谢谢(1)该企业生产A,B两种产品,根据月末编 2020-06-10 …
成本会计作业,华南厂本月生产A、B、C三种产品,其直接用于产品生产的主要材料是直接费用华南厂本月生 2020-06-15 …
宜宾市某化工厂,现有A种原料52千克,B种原料64千克,现用这些原料生产甲、乙两种产品共20件.已 2020-06-15 …
某厂用鲜牛奶在某台设备上生产A,B两种奶制品.生产1吨A产品需鲜牛奶2吨,使用设备1小时,获利10 2020-06-17 …
火山喷发所产生的硫黄可用于生产重要的化工原料硫酸.某企业用如图1所示的工艺流程生产硫酸:请回答下列 2020-06-26 …
(1)硫酸的用途非常广泛,可应用于下列哪些方面火山喷发所产生的硫黄可用于生产重要的化工原料硫酸.某 2020-06-26 …
A公司生产甲产品需要使用一种直接材料X,本期生产甲产品1000件,耗用A材料9000千克,X材料的 2020-07-17 …