早教吧作业答案频道 -->化学-->
某中药主要含二硫化亚铁(FeS2),某学习小组欲用图1所示装置进行实验,测定其铁、硫元素的质量分数.(1)装置中,A为高温灼烧装置,B为气体吸收装置,C为检测尾气中是否含有SO2的传
题目详情
某中药主要含二硫化亚铁(FeS2),某学习小组欲用图1所示装置进行实验,测定其铁、硫元素的质量分数.
(1)装置中,A为高温灼烧装置,B为气体吸收装置,C为检测尾气中是否含有SO2的传感器.取m g该中药样品于装置A中,经充分反应,使硫元素全部转化为SO2和SO3,在B中得到白色沉淀,传感器(装置C)未检测到SO2.
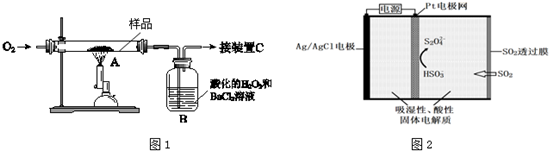
①装置B中的H2O2反应时表现出了___性.
②欲计算硫元素的质量分数,需测量的数据是___.
③传感器的工作原理如图2所示.
传感器中阴极的电极反应式是___.
(2)为测定铁元素的质量分数,继续实验.
a.将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生.充分反应后过滤,得到黄色滤液;
b.向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被氧化为TiO2+;
c.用滴定法测定Fe2+的量,消耗v mL n mol/LK2Cr2O7溶液.
①a中滤液含有的金属阳离子是___.
②b中反应的离子方程式是___.
③c中K2Cr2O7被还原为Cr3+,样品中铁元素质量分数的数学表示式是___.
(1)装置中,A为高温灼烧装置,B为气体吸收装置,C为检测尾气中是否含有SO2的传感器.取m g该中药样品于装置A中,经充分反应,使硫元素全部转化为SO2和SO3,在B中得到白色沉淀,传感器(装置C)未检测到SO2.

①装置B中的H2O2反应时表现出了___性.
②欲计算硫元素的质量分数,需测量的数据是___.
③传感器的工作原理如图2所示.
传感器中阴极的电极反应式是___.
(2)为测定铁元素的质量分数,继续实验.
a.将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生.充分反应后过滤,得到黄色滤液;
b.向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被氧化为TiO2+;
c.用滴定法测定Fe2+的量,消耗v mL n mol/LK2Cr2O7溶液.
①a中滤液含有的金属阳离子是___.
②b中反应的离子方程式是___.
③c中K2Cr2O7被还原为Cr3+,样品中铁元素质量分数的数学表示式是___.
▼优质解答
答案和解析
(1)①取m g该中药样品于装置A中,经充分反应,FeS2燃烧生成二氧化硫和氧化铁,二氧化硫通入酸化的过氧化氢和氯化钡溶液中,使硫元素全部转化为SO2和SO3,在B中得到白色沉淀,发生氧化还原反应生成硫酸钡沉淀;过氧化氢的主要作用是氧化剂氧化+4价硫为+6价硫酸根离子,装置B中的H2O2反应时表现出了氧化性,
故答案为:氧化;
②欲计算硫元素的质量分数,需要测定B中沉淀质量计算硫元素物质的量,所以测量的数据是B中沉淀的质量,
故答案为:B中沉淀的质量;
③阴极发生还原反应,酸溶液中亚硫酸氢根离子得到电子生成S2O42-,电极反应为2HSO3-+2H++2e-=S2O42-+2H2O,
故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;
(2)①将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生证明含有铁,充分反应后过滤,得到黄色滤液,说明含有氧化铁,所以盐酸溶解后得到溶液中含有阳离子为:Fe3+、Fe2+,
故答案为:Fe3+、Fe2+;
②向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被铁离子氧化为TiO2+,反应的离子方程式为:Fe3++Ti3++H2O=Fe2++TiO2++2H+;
故答案为:Fe3++Ti3++H2O=Fe2++TiO2++2H+;
③用滴定法测定Fe2+的量,消耗v mL n mol/LK2Cr2O7溶液,则
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n(Fe2+) v×10-3L×n mol/L
n=6vn×10-3mol
样品中铁元素质量分数=
×100%=
vn×100%=
×100%=
%,
故答案为:
%.
故答案为:氧化;
②欲计算硫元素的质量分数,需要测定B中沉淀质量计算硫元素物质的量,所以测量的数据是B中沉淀的质量,
故答案为:B中沉淀的质量;
③阴极发生还原反应,酸溶液中亚硫酸氢根离子得到电子生成S2O42-,电极反应为2HSO3-+2H++2e-=S2O42-+2H2O,
故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;
(2)①将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生证明含有铁,充分反应后过滤,得到黄色滤液,说明含有氧化铁,所以盐酸溶解后得到溶液中含有阳离子为:Fe3+、Fe2+,
故答案为:Fe3+、Fe2+;
②向滤液中滴加TiCl3溶液,至恰好完全反应,TiCl3被铁离子氧化为TiO2+,反应的离子方程式为:Fe3++Ti3++H2O=Fe2++TiO2++2H+;
故答案为:Fe3++Ti3++H2O=Fe2++TiO2++2H+;
③用滴定法测定Fe2+的量,消耗v mL n mol/LK2Cr2O7溶液,则
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n(Fe2+) v×10-3L×n mol/L
n=6vn×10-3mol
样品中铁元素质量分数=
| 6vn×10-3mol×56g/mol |
| mg |
| 0.336 |
| m |
| 0.336vn |
| m |
| 33.6nv |
| m |
故答案为:
| 33.6nv |
| m |
看了某中药主要含二硫化亚铁(FeS...的网友还看了以下:
酸、碱、盐是初中化学学习的重要内容,同学们在实验室对酸、碱、盐的性质进行探究.(1)酸和碱的组成中 2020-05-15 …
细菌内毒素检查法主要依靠细菌内毒素可以活化(),来检测细菌内毒素。A、凝固蛋白原B、凝固酶原C、B 2020-06-07 …
肿瘤的定性检查主要方法是A.磁共振B.CT扫描C.B型超声D.病理检查E.核素检查 2020-06-07 …
如图表示正常哺乳动物体内多种分泌细胞及它们分泌的激素之间的关系.以下对该图中相关内容的叙述,正确的 2020-06-20 …
(2013•绵阳三模)甲状腺激素是人体中一种很重要的激素,其含量过多或过少均会导致人体生理过程异常 2020-07-14 …
微量元素检查中铅的参考范围0-100,检验结果为46是什么意思我孩子⒊个月了做了为量元素的检查其中检 2020-11-11 …
人体内的微量元素检测请问泰州人民医院能不能做微量元素检测啊? 2020-11-12 …
地图是学习地理的第二语言,下列关于地图的相关知识中,错误的是()A.比例尺、方向和图例、注记是地图的 2020-11-24 …
图1是A、B、C微粒的结构示意图,图2是两种元素在元素周期表中的信息(1)图2中方框内的横线上应填的 2020-12-07 …
(2010•惠安县质检)锶原子钟利用锶原子振动极度一致的自然属性,科学家制造出了世界最精确的时钟.在 2020-12-19 …