早教吧作业答案频道 -->化学-->
叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,其中氢叠氮酸(HN3)是一种弱酸,分子结构示意图可表示为:联氨被亚硝酸氧化时便可生
题目详情
叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,其中氢叠氮酸(HN3)是一种弱酸,分子结构示意图可表示为:
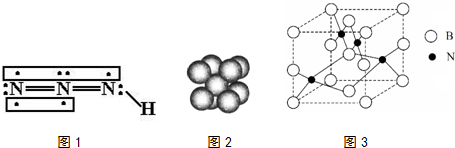
联氨被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3,它的酸性类似于醋酸,微弱电离出H+和N3-.试回答下列问题:
(1)下列有关说法正确的是___(选填序号).
A.HN3中含有5个σ键
B.HN3中三个氮原子采用的都是sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.肼(N2H4)沸点高达113.5℃,说明肼分子间可形成氢键
(2)叠氮化物能与Fe3+及Cu2+及Co3+等形成配合物,如:Co[(N3)(NH3)5]SO4,在该配合物
中钴显___价,根据价层互斥理论可知SO42-空间形状为___,写出钴原子在基态时的核外电子排布式___.
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)═2Na(l)+3N2(g),有关说法正确的是
___(选填序号)
A.NaN3与KN3结构类似,前者晶格能较小
B.钠晶胞结构如图2,晶胞中分摊2个钠原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮的电负性小
(4)与N3-互为等电子体的分子有___(举2例)
(5)人造立方氮化硼的硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料.立方氮化硼晶胞如图3所示,试分析:
①该晶体的类别为___晶体.
②晶体中每个N同时吸引___个B.
③设该晶体的摩尔质量为M g•mol-1,晶体的密度为ρg•cm-3,阿伏加德罗常数的值为NA,则晶体
中两个距离最近的B之间的距离为___cm.

联氨被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3,它的酸性类似于醋酸,微弱电离出H+和N3-.试回答下列问题:
(1)下列有关说法正确的是___(选填序号).
A.HN3中含有5个σ键
B.HN3中三个氮原子采用的都是sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.肼(N2H4)沸点高达113.5℃,说明肼分子间可形成氢键
(2)叠氮化物能与Fe3+及Cu2+及Co3+等形成配合物,如:Co[(N3)(NH3)5]SO4,在该配合物
中钴显___价,根据价层互斥理论可知SO42-空间形状为___,写出钴原子在基态时的核外电子排布式___.
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)═2Na(l)+3N2(g),有关说法正确的是
___(选填序号)
A.NaN3与KN3结构类似,前者晶格能较小
B.钠晶胞结构如图2,晶胞中分摊2个钠原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮的电负性小
(4)与N3-互为等电子体的分子有___(举2例)
(5)人造立方氮化硼的硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料.立方氮化硼晶胞如图3所示,试分析:
①该晶体的类别为___晶体.
②晶体中每个N同时吸引___个B.
③设该晶体的摩尔质量为M g•mol-1,晶体的密度为ρg•cm-3,阿伏加德罗常数的值为NA,则晶体
中两个距离最近的B之间的距离为___cm.
▼优质解答
答案和解析
(1)A.共价单键为σ键,共价双键中1个是σ键、1个是π键,所以该分子中含有3个σ键,故错误;
B.HN3中三个N原子价层电子对个数不相同,所以其杂化方式不同,故错误;
C.分子正负电荷重心不重合的为极性分子,这几种分子正负电荷重心都不重合,为极性分子,故正确;
D.形成氢键的氢化物熔沸点较高,该氢化物熔沸点大于水,含有氢键,故正确;
故选CD;
(2)该配合物中叠氮酸根离子为-1价、硫酸根离子为-2价,根据化合物中各元素化合价的代数和为0知,Co元素化合价为+3价;硫酸根离子价层电子对个数是4且不含孤电子对,根据价层电子对互斥理论判断硫酸根离子空间构型为正四面体形;Co是27号元素,其原子核外有27个电子,根据构造原理书写其基态原子核外电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2,
故答案为:+3;正四面体;1s22s22p63s23p63d74s2或[Ar]3d74s2;
(3)A.NaN3与KN3结构类似,且二者都是离子晶体,晶格能与离子半径成反比,钾离子半径大于钠离子,所以前者晶格能大于后者,故错误;
B.晶胞中Na原子个数=8×
+1=2,故正确;
C.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素,所以第一电离能N>O,故正确;
D.氮气分子中含有氮氮三键,键能较大,性质较稳定,故错误;
故选BC;
(4)原子个数相等价电子数相等的微粒互为等电子体,与N3-互为等电子体的分子有N2O、CO2、CS2、BeF2等,故答案为:N2O、CO2、CS2、BeF2等;
(5)①原子晶体硬度大,该晶体硬度大,所以为原子晶体,故答案为:原子;
②每个N原子同时吸引4个B原子,所以其配位数是4,故答案为:4;
③晶体中两个距离最近的B之间的距离为晶胞棱长的
倍,晶胞棱长=
,则晶体中两个距离最近的B之间的距离=
×
cm=
×
cm=
cm,
故答案为:
.
B.HN3中三个N原子价层电子对个数不相同,所以其杂化方式不同,故错误;
C.分子正负电荷重心不重合的为极性分子,这几种分子正负电荷重心都不重合,为极性分子,故正确;
D.形成氢键的氢化物熔沸点较高,该氢化物熔沸点大于水,含有氢键,故正确;
故选CD;
(2)该配合物中叠氮酸根离子为-1价、硫酸根离子为-2价,根据化合物中各元素化合价的代数和为0知,Co元素化合价为+3价;硫酸根离子价层电子对个数是4且不含孤电子对,根据价层电子对互斥理论判断硫酸根离子空间构型为正四面体形;Co是27号元素,其原子核外有27个电子,根据构造原理书写其基态原子核外电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2,
故答案为:+3;正四面体;1s22s22p63s23p63d74s2或[Ar]3d74s2;
(3)A.NaN3与KN3结构类似,且二者都是离子晶体,晶格能与离子半径成反比,钾离子半径大于钠离子,所以前者晶格能大于后者,故错误;
B.晶胞中Na原子个数=8×
| 1 |
| 8 |
C.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素,所以第一电离能N>O,故正确;
D.氮气分子中含有氮氮三键,键能较大,性质较稳定,故错误;
故选BC;
(4)原子个数相等价电子数相等的微粒互为等电子体,与N3-互为等电子体的分子有N2O、CO2、CS2、BeF2等,故答案为:N2O、CO2、CS2、BeF2等;
(5)①原子晶体硬度大,该晶体硬度大,所以为原子晶体,故答案为:原子;
②每个N原子同时吸引4个B原子,所以其配位数是4,故答案为:4;
③晶体中两个距离最近的B之间的距离为晶胞棱长的
| 1 |
| 2 |
| 3 |
| ||
| 1 |
| 2 |
| 3 |
| ||
| 1 |
| 2 |
| 3 |
| ||
| 3 |
| ||
故答案为:
| 3 |
| ||
看了叠氮化物是一类重要化合物,在炸...的网友还看了以下:
联系课文理解句子意思.人生有无数条轨道可走,之所以选择了其中的一条,是偶然,更是必然.()联系联系 2020-05-13 …
一个开关同时控制两盏灯泡的亮与灭,则这两盏灯泡1串联或并联都可以2并联3串联一个开关同时控制两盏灯 2020-05-14 …
电路图中有一点比较疑惑,好像有时候电流遇到用电器就绕开,走没有用电器的一条路,可有时两条路又都走, 2020-05-16 …
任何两个词经过联想都可以联系起来,如"沙漠""篮球"是两个意义相距很远的词语,但中间只要加入你的联 2020-05-17 …
在两只电灯的串联电路中,以下说法不正确的是在两只电灯的串联电路中,以下说法中不正确的是()A.通过 2020-05-20 …
由一寸土地一寸金可以联想到俗语:,你从这个俗语中悟道到了什么由一寸土地一寸金可以联想到俗语:,你从 2020-05-23 …
一道物理题(说出过程追分)某用电器电阻为90(OU),若使通过用电器是总电流的1/4,应在这个电器 2020-06-06 …
物理:关于并联分流作用串联一个电阻可以分压,即串联一个定植电阻,可以分的一部分电压,但是并联可以分 2020-06-07 …
电压表由电流计G与电阻R串联而成,如图所示.在使用过程中发现,电压表的读数总比准确值稍小一些,下列 2020-06-15 …
名联柳影入池鱼上树,槐荫铺地马蹬枝,既是一幅画也是一首诗,鱼不可能上树,马也不可能登上枝头,但有了 2020-06-18 …