早教吧作业答案频道 -->化学-->
向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是()A、在0-a范围内,只发生中和反应
题目详情
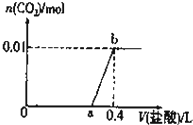 向NaOH和Na 2 CO 3 混合溶液中滴加0.1mol/L稀盐酸,CO 2 的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是( )
向NaOH和Na 2 CO 3 混合溶液中滴加0.1mol/L稀盐酸,CO 2 的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是( )| A、在0-a范围内,只发生中和反应 |
| B、原混合溶液中NaOH与Na 2 CO 3 的物质的量之比为1:2 |
| C、a=0.3 |
| D、ab段发生反应的离子方程式为:CO 3 2- +2H + =H 2 O+CO 2 |
▼优质解答
答案和解析
考点:
有关混合物反应的计算
专题:
分析:
向NaOH和Na2CO3混合配成的溶液中滴加盐酸时,先发生氢氧化钠与盐酸的中和反应:NaOH+HCl=NaCl+H2O,氢氧化钠反应完毕后再发生碳酸钠与盐酸的反应:HCl+Na2CO3=NaHCO3+NaCl,最后发生发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑,利用物质的量的关系并结合图象即可解答.
A.向NaOH和Na2CO3混合溶液中滴加盐酸时,首先和NaOH反应生成水和氯化钠:NaOH+HCl=NaCl+H2O,继续滴加时,盐酸与Na2CO3首先发生反应:HCl+Na2CO3=NaHCO3+NaCl,不会不放出气体,继续滴加时发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑,则在0-a范围内发生反应为:NaOH+HCl=NaCl+H2O、HCl+Na2CO3=NaHCO3+NaCl,故A错误;B.根据碳元素守恒,混合物中碳酸钠的物质的量是0.01mol,b点消耗盐酸的物质的量为0.11mol/L×0.4L=0.04mol,则a点氯化氢的物质的量为:0.04mol-0.01=0.03mol,根据反应HCl+Na2CO3=NaHCO3+NaCl可知,0.01mol碳酸钠消耗0.01mol氯化氢生成碳酸氢钠,则氢氧化钠的物质的量为0.03mol-0.01mol=0.02mol,所以原混合溶液中NaOH与Na2CO3的物质的量之比为0.02mol:0.01mol=1:1,故B错误;C.根据B可知,a点消耗氯化氢的物质的量为0.03mol,则消耗0.1mol?L-1稀盐酸的体积分别为0.03mol0.1mol/L=0.3L,所以a=0.3,故C正确;D.ab段发生反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,反应的离子方程式为:HCO3-+H+=H2O+CO2↑,故D错误;故选C.
点评:
本题考查了元素化合物、图象数据的处理知识,题目难度中等,需要明确向碳酸钠溶液中滴加盐酸的反应是分步进行的,首先发生:HCl+Na2CO3=NaHCO3+NaCl,然后再发生反应NaHCO3+HCl=NaCl+H2O+CO2↑,为易错点.
考点:
有关混合物反应的计算
专题:
分析:
向NaOH和Na2CO3混合配成的溶液中滴加盐酸时,先发生氢氧化钠与盐酸的中和反应:NaOH+HCl=NaCl+H2O,氢氧化钠反应完毕后再发生碳酸钠与盐酸的反应:HCl+Na2CO3=NaHCO3+NaCl,最后发生发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑,利用物质的量的关系并结合图象即可解答.
A.向NaOH和Na2CO3混合溶液中滴加盐酸时,首先和NaOH反应生成水和氯化钠:NaOH+HCl=NaCl+H2O,继续滴加时,盐酸与Na2CO3首先发生反应:HCl+Na2CO3=NaHCO3+NaCl,不会不放出气体,继续滴加时发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑,则在0-a范围内发生反应为:NaOH+HCl=NaCl+H2O、HCl+Na2CO3=NaHCO3+NaCl,故A错误;B.根据碳元素守恒,混合物中碳酸钠的物质的量是0.01mol,b点消耗盐酸的物质的量为0.11mol/L×0.4L=0.04mol,则a点氯化氢的物质的量为:0.04mol-0.01=0.03mol,根据反应HCl+Na2CO3=NaHCO3+NaCl可知,0.01mol碳酸钠消耗0.01mol氯化氢生成碳酸氢钠,则氢氧化钠的物质的量为0.03mol-0.01mol=0.02mol,所以原混合溶液中NaOH与Na2CO3的物质的量之比为0.02mol:0.01mol=1:1,故B错误;C.根据B可知,a点消耗氯化氢的物质的量为0.03mol,则消耗0.1mol?L-1稀盐酸的体积分别为0.03mol0.1mol/L=0.3L,所以a=0.3,故C正确;D.ab段发生反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,反应的离子方程式为:HCO3-+H+=H2O+CO2↑,故D错误;故选C.
点评:
本题考查了元素化合物、图象数据的处理知识,题目难度中等,需要明确向碳酸钠溶液中滴加盐酸的反应是分步进行的,首先发生:HCl+Na2CO3=NaHCO3+NaCl,然后再发生反应NaHCO3+HCl=NaCl+H2O+CO2↑,为易错点.
看了向NaOH和Na2CO3混合溶...的网友还看了以下:
厨房的食醋中含有乙酸,其化学式为CH3COOH.下列有关乙酸的说法正确的是()A.乙酸由2个碳原子 2020-04-11 …
希望有人帮忙,急)下列离子方程式中书写正确的是下列离子方程式中书写正确的是 ()A.实验室用大理石 2020-05-16 …
20.将浓盐酸和浓硫酸混合时,说法正确的是( )20.将浓盐酸和浓硫酸混合时,说法正确的是( )A 2020-05-16 …
熟石灰和稀硫酸反应是中和反应吗?Ca(OH)2+H2SO4----CaSO4+2H2OCaSO4是 2020-05-16 …
需要你将硫酸、氢氟酸、盐酸和氢氧化钠各一瓶从化学品柜搬到通风橱内,正确的方法是A.硫酸和盐酸同一次 2020-07-02 …
物理物理。高手进叭现在要利用下列四种方法配制10%的硝酸钾溶液,请你求出各种方法中所用物质质量的最 2020-07-02 …
(2/2)硝酸酸化(为什么要酸化),再滴AgNO3溶液(有什么用?),观察沉淀的颜色,确定是何种卤 2020-07-03 …
食醋是厨房中的一种调味品,其中含有少量醋酸,其分子结构如图所示.下列有关醋酸的说法正确的是()A. 2020-07-14 …
下列说法不正确的是()A.二甲苯和四甲苯均有三种B.利用核磁共振氢谱可以鉴别1-丙醇和2-丙醇C. 2020-07-29 …
下列说法正确的是()A.蔗糖及其水解产物均能发生银镜反应B.用酸性KMnO4溶液即可鉴别2-丁烯和正 2020-11-03 …