早教吧作业答案频道 -->化学-->
回答下列问题:(1)SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2.钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是.常温下,Na2SO3溶液的pH7,原因是(用
题目详情
回答下列问题:
(1)SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2.钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是___.常温下,Na2SO3溶液的pH___7,原因是(用离子方程式表示)___.
(2)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
已知:SO2(g)+
O2(g)⇌SO3(g)△H=-98kJ•mol-1.某温度下该反应的平衡常数K=
.
①该温度下,向100L的恒容密闭容器中,充入3.0mol SO2(g)、16.0mol O2(g)和3.0mol SO3(g),则反应开始时v(正)___ v(逆)(填“<”、“>”或“=”).
②该温度下,向一体积为2L的恒容密闭容器中充入2.0mol SO2和1.0molO2,反应一段时间后容器压强为反应前的80%,此时SO2的转化率为___.
③在②中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是___(填字母).
A.保持温度和容器体积不变,充入1.0mol O2
B.降低温度
C.保持温度和容器体积不变,充入1.0mol SO3
D.增大容器体积
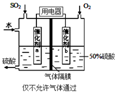
(3)若以如图所示装置,用电化学原理生产硫酸,通入O2电极的电极反应式为___
(4)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为___.

(1)SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2.钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是___.常温下,Na2SO3溶液的pH___7,原因是(用离子方程式表示)___.
(2)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
已知:SO2(g)+
| 1 |
| 2 |
| 10 |
| 3 |
①该温度下,向100L的恒容密闭容器中,充入3.0mol SO2(g)、16.0mol O2(g)和3.0mol SO3(g),则反应开始时v(正)___ v(逆)(填“<”、“>”或“=”).
②该温度下,向一体积为2L的恒容密闭容器中充入2.0mol SO2和1.0molO2,反应一段时间后容器压强为反应前的80%,此时SO2的转化率为___.
③在②中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是___(填字母).
A.保持温度和容器体积不变,充入1.0mol O2
B.降低温度
C.保持温度和容器体积不变,充入1.0mol SO3
D.增大容器体积
(3)若以如图所示装置,用电化学原理生产硫酸,通入O2电极的电极反应式为___
(4)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为___.
▼优质解答
答案和解析
(1)Na2SO3溶液吸收SO2气体生成NaHSO3,时发生反应的离子方程式为:SO2+SO32-+H2O=2HSO3-;Na2SO3为强碱弱酸盐,SO32-水解使得溶液显碱性,pH>7,且分步水解,水解反应离子方程式为SO32-+H2O⇌HSO3-+OH-;
故答案为:SO2+SO32-+H2O=2HSO3-;>;SO32-+H2O⇌HSO3-+OH-;
(2)①此时浓度商Qc=
=
>K=
,反应向逆反应进行,则v(正)<v(逆),
故答案为:<;
②恒温恒压下,压强之比等于物质的量之比,则平衡后混合气体物质的量为(2+1)mol×
=2.4mol,则:
2SO2(g)+O2(g)⇌2SO3(g)△n
2 1
1.2mol 3mol-2.4mol=0.6mol
则SO2的平衡转化率为
×100%=60%,
故答案为:60%;
③A.保持温度和容器体积不变,充入1.0 mol O2,平衡正向移动,SO2(g)平衡浓度比原来减小,故A正确;
B.保持温度和容器内压强不变,充入1.0 mol SO3,与原平衡为等效平衡,SO2(g)平衡浓度与原来相等,故B错误;
C.降低温度,平衡正向移动,平衡常数增大,容器的容积减小,三氧化硫的浓度增大,由于体系中二氧化硫与氧气的浓度之比为2:1,故二者浓度增大,故SO2(g)平衡浓度比原来增大,故C错误;
D.移动活塞压缩气体,压强增大,平衡正向移动,三氧化硫浓度增大,平衡常数不变,二氧化硫与氧气浓度均增大,故D错误,
故选:A;
(3)用电化学原理生产硫酸,气体隔膜不能使气体通过,右侧通入氧气,发生还原反应,左侧发生氧化反应,SO2电极上SO2失去电子氧化生成硫酸,电极反应式为:SO2失去电子氧化生成硫酸,SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
(4)原溶液为50%硫酸,则溶液中n(H2SO4):n(H2O)=
:
=9:49,
2SO2+O2+2H2O=2H2SO4
9mol 9mol 9mol
故通入SO2和水的质量比为9mol×64g/mol:(9mol+49mol)×18g/mol=16:29,
故答案为:16:29.
故答案为:SO2+SO32-+H2O=2HSO3-;>;SO32-+H2O⇌HSO3-+OH-;
(2)①此时浓度商Qc=
| 0.032 |
| 0.032×0.06 |
| 50 |
| 3 |
| 10 |
| 3 |
故答案为:<;
②恒温恒压下,压强之比等于物质的量之比,则平衡后混合气体物质的量为(2+1)mol×
| 1.6L |
| 2L |
2SO2(g)+O2(g)⇌2SO3(g)△n
2 1
1.2mol 3mol-2.4mol=0.6mol
则SO2的平衡转化率为
| 1.2mol |
| 2mol |
故答案为:60%;
③A.保持温度和容器体积不变,充入1.0 mol O2,平衡正向移动,SO2(g)平衡浓度比原来减小,故A正确;
B.保持温度和容器内压强不变,充入1.0 mol SO3,与原平衡为等效平衡,SO2(g)平衡浓度与原来相等,故B错误;
C.降低温度,平衡正向移动,平衡常数增大,容器的容积减小,三氧化硫的浓度增大,由于体系中二氧化硫与氧气的浓度之比为2:1,故二者浓度增大,故SO2(g)平衡浓度比原来增大,故C错误;
D.移动活塞压缩气体,压强增大,平衡正向移动,三氧化硫浓度增大,平衡常数不变,二氧化硫与氧气浓度均增大,故D错误,
故选:A;
(3)用电化学原理生产硫酸,气体隔膜不能使气体通过,右侧通入氧气,发生还原反应,左侧发生氧化反应,SO2电极上SO2失去电子氧化生成硫酸,电极反应式为:SO2失去电子氧化生成硫酸,SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
(4)原溶液为50%硫酸,则溶液中n(H2SO4):n(H2O)=
| 1 |
| 98 |
| 1 |
| 18 |
2SO2+O2+2H2O=2H2SO4
9mol 9mol 9mol
故通入SO2和水的质量比为9mol×64g/mol:(9mol+49mol)×18g/mol=16:29,
故答案为:16:29.
看了回答下列问题:(1)SO2是造...的网友还看了以下:
溴元素的符号为Br,如图1是Br-(溴离子)的结构示意图.(1)如图1中x=.(2)溴属于元素(填 2020-05-13 …
碘是人体必须得一种微量元素.碘元素的符号为I,图1是I-(碘离子)的结构示意图.(1)图1中x=. 2020-05-13 …
常温下,0.1mol•L-1某一元酸HA溶液中c(OH−)c(H+)=1×10-8.下列叙述正确的 2020-05-14 …
如图为尿液形成过程示意图(序号表示结构),以下说法不正确的是()A.与1中液体相比,2中液体不含大 2020-05-14 …
如图是显微镜的结构示意图和植物细胞结构模式图,看图回答下列问题:(1)用显微镜观察人血的永久涂片, 2020-05-15 …
在25℃下,将amol•L-1的醋酸(HAc)与0.01mol•L-1的氢氧化钠溶液等体积混合,反 2020-05-16 …
下列说法正确的是 [ C ]A.1 L水中溶解1 mol NaCl所形成溶液的物质的量浓度是1 m 2020-05-16 …
如图为尿液形成过程示意图,序号表示相关结构,下列说法正确的是()A.与1中液体相比,2中液体葡萄糖 2020-06-22 …
利用双缝干涉测光的波长的实验中,双缝间距d=0.4mm,双缝到光屏间的距离l=0.5m,用某种单色 2020-06-27 …
图1是某生态系统碳循环和能量流动示意图,图2是该生态系统中某些生物的相对数量关系示意图.请据图分析 2020-06-27 …