早教吧作业答案频道 -->化学-->
铁及其化合物在日常生活中有广泛应用.(1)写出Fe与稀H2SO4反应的化学方程式.(2)绿矾(FeSO4•7H2O)是补血剂的原料,易变质,检验是否变质的试剂是.(3)聚合硫酸铁(PFS)是
题目详情
铁及其化合物在日常生活中有广泛应用.
(1)写出Fe与稀H2SO4反应的化学方程式___.
(2)绿矾(FeSO4•7H2O) 是补血剂的原料,易变质,检验是否变质的试剂是___.
(3)聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理,用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe 3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+,实验步骤如下: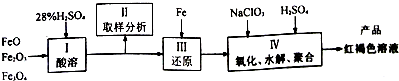
①用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒、玻璃棒外,还有___(选填标号)
a.容量瓶 b.烧杯 c.烧瓶
②Ⅲ中主要反应的离子方程式是___.
③写出Ⅳ中用NaClO3氧化Fe2+时的离子反应方程式___,若改用HNO3氧化,则反应方程式如下:6FeSO4+2HNO3+3H2SO4═3Fe2(SO4)3+2NO↑+4H2O 但缺点是___.
聚合硫酸铁的化学式是[Fe2(OH)n(SO4)3-0.5n]m,运用沉淀法测定聚合硫酸铁产品溶液中Fe3+与SO
物质的量之比.
④需要测定Fe2O3和___的质量(填写化合物的化学式).
⑤测定过程中所需的基本操作除过滤、洗涤外,还有___(选填标号)
a.萃取、分液 b.蒸发、结晶 c.冷却、称量 d.烘干或灼烧.
(1)写出Fe与稀H2SO4反应的化学方程式___.
(2)绿矾(FeSO4•7H2O) 是补血剂的原料,易变质,检验是否变质的试剂是___.
(3)聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理,用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe 3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+,实验步骤如下:

①用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒、玻璃棒外,还有___(选填标号)
a.容量瓶 b.烧杯 c.烧瓶
②Ⅲ中主要反应的离子方程式是___.
③写出Ⅳ中用NaClO3氧化Fe2+时的离子反应方程式___,若改用HNO3氧化,则反应方程式如下:6FeSO4+2HNO3+3H2SO4═3Fe2(SO4)3+2NO↑+4H2O 但缺点是___.
聚合硫酸铁的化学式是[Fe2(OH)n(SO4)3-0.5n]m,运用沉淀法测定聚合硫酸铁产品溶液中Fe3+与SO
| 2- 4 |
④需要测定Fe2O3和___的质量(填写化合物的化学式).
⑤测定过程中所需的基本操作除过滤、洗涤外,还有___(选填标号)
a.萃取、分液 b.蒸发、结晶 c.冷却、称量 d.烘干或灼烧.
▼优质解答
答案和解析
(1)Fe与稀H2SO4反应生成硫酸亚铁和氢气,反应方程式为Fe+H2SO4=FeSO4+H2↑,
故答案为:Fe+H2SO4=FeSO4+H2↑;
(2)绿矾(FeSO4•7H2O) 是补血剂的原料,易变质生成三价铁离子,检验是否变质即检验三价铁离子,可以用KSCN溶液,
故答案为:KSCN溶液;
(3)铁的氧化物溶解于硫酸中取样分析溶液中的Fe2+、Fe3+的含量,因为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+先被还原为Fe2+;所以确定下一步还原所需铁的量,再被氧化为Fe3+;需要确定氧化Fe2+所需NaClO3的量,通过氧化、水解、聚合得到产品,
①用浓硫酸配稀硫酸的基本步骤是计算、量取、溶解,配制一定量分数硫酸溶液需要的仪器有:胶头滴管、量筒、玻璃棒、烧杯,
故答案为:b;
②Ⅲ中主是用铁将Fe3+还原为Fe2+,反应的离子方程式为Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+;
③用NaClO3氧化Fe2+时,氯酸根离子被还原成氯离子,亚铁离子被氧化成铁离子,反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,如果用用硝酸氧化,则产物中有一氧化氮,污染空气,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;产生的气体对空气有污染;
④根据测定Fe2O3来测定Fe3+的物质的量,根据测定 BaSO4的质量来测定SO42¯的物质的量考虑,
故答案为:BaSO4;
⑤根据测定沉淀的质量分析基本步骤,从溶液中获得沉淀,要先过滤、洗涤,烘干或灼烧,冷却再称量沉淀质量,根据沉淀质量再进行计算即可,
故选cd.
故答案为:Fe+H2SO4=FeSO4+H2↑;
(2)绿矾(FeSO4•7H2O) 是补血剂的原料,易变质生成三价铁离子,检验是否变质即检验三价铁离子,可以用KSCN溶液,
故答案为:KSCN溶液;
(3)铁的氧化物溶解于硫酸中取样分析溶液中的Fe2+、Fe3+的含量,因为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+先被还原为Fe2+;所以确定下一步还原所需铁的量,再被氧化为Fe3+;需要确定氧化Fe2+所需NaClO3的量,通过氧化、水解、聚合得到产品,
①用浓硫酸配稀硫酸的基本步骤是计算、量取、溶解,配制一定量分数硫酸溶液需要的仪器有:胶头滴管、量筒、玻璃棒、烧杯,
故答案为:b;
②Ⅲ中主是用铁将Fe3+还原为Fe2+,反应的离子方程式为Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+;
③用NaClO3氧化Fe2+时,氯酸根离子被还原成氯离子,亚铁离子被氧化成铁离子,反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,如果用用硝酸氧化,则产物中有一氧化氮,污染空气,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;产生的气体对空气有污染;
④根据测定Fe2O3来测定Fe3+的物质的量,根据测定 BaSO4的质量来测定SO42¯的物质的量考虑,
故答案为:BaSO4;
⑤根据测定沉淀的质量分析基本步骤,从溶液中获得沉淀,要先过滤、洗涤,烘干或灼烧,冷却再称量沉淀质量,根据沉淀质量再进行计算即可,
故选cd.
看了铁及其化合物在日常生活中有广泛...的网友还看了以下:
英语翻译与合作是现代社会必备的.因为与人合作不仅可以省时间和精力,更能增加相互的学习机会.在生活中 2020-06-11 …
与正常细胞相比,癌细胞中活性明显偏低的酶是()A.与DNA复制有关的酶B.与细胞呼吸有关的酶C.与 2020-07-01 …
无限集合与有限集合最本质的差异是什么 2020-07-14 …
一个人的健康与他的日常生活习惯有着密切的关系.健康的生活习惯包括生活有、合理、合理用药及拒绝吸烟、酿 2020-11-05 …
生活中需要合作,合作是件美好的事情,合作的目标是寻求合作双方的共赢。思考并回答:(1)请说说你在学校 2020-11-07 …
研究发现,癌细胞中许多酶的活性与正常细胞相比明显偏高,但这些活性偏高的酶一般不包括()A.与DNA复 2020-12-07 …
一个人的健康与他的日常生活习惯有着密切的关系。健康的生活习惯包括生活有、合理、合理用药及拒绝吸烟、酗 2020-12-24 …
如图是鲫鱼的外形图,请据图填空.(横线内填序号,上填写相应的名称)(1)当鲫鱼处于静止状态时,可见③ 2020-12-25 …
有些地方把特有的传统文化活动与现代城市流行元素相结合,把传统文化体验与文化产业发展相结合,赋予传统文 2021-01-13 …
为了调查胃病是否与生活规律有关,对某地70名40岁以上的人进行调查,结果如下:患胃病未患胃病合计生活 2021-01-13 …