早教吧作业答案频道 -->化学-->
硫酸钠与工农业生产、生活紧密相关,工业硫酸钠大多采用侯氏制碱法制取.Ⅰ.实验室欲模拟侯氏制碱法来制备纯碱Na2CO3,需要的CO2气体用下图中的装置A来制备.优点是可随用随停.如图
题目详情
硫酸钠与工农业生产、生活紧密相关,工业硫酸钠大多采用侯氏制碱法制取.
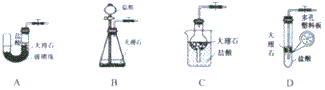
Ⅰ.实验室欲模拟侯氏制碱法来制备纯碱Na2CO3,需要的CO2气体用下图中的装置A来制备.优点是可随用随停.如图中的装置B、C、D中与A具有相同工作原理也可制备CO2气体的是___(填写字母).
Ⅱ.制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题:
方案一:把一定质量的样品溶解后加入过量的CaCL2溶液,将所得沉淀___(填操作名称)、洗涤、烘干、称量、计算、洗涤沉淀的具体操作是___
方案二:把一定量的样品与足量硫酸反应后,用如图1所示装置测定产生CO2的体积,为了确保测定结果的准确性,B中的溶液最好采用___.如图装置中实验仪器a的名称是___.
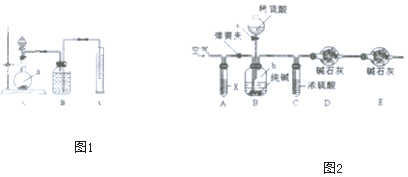
方案三:利用如图2所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:
①按图连接装置,并检查气密性;
②准备称得盛有碱石灰的干燥管D的质量为33.4g;
③准备称得6g纯碱样品放入容器b中;
④打开分液漏斗a的胶塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为35.6g.
(1)若④⑤两步的实验操作太快,则会导致测定结果___(填“偏大”或“偏小”).
(2)装置A中试剂X应选用___.
(3)E装置的作用是___.
(4)根据实验中测得的有关数据,计算出纯碱样品Na2CO3的质量百分数为___(结果保留一位小数).
Ⅰ.实验室欲模拟侯氏制碱法来制备纯碱Na2CO3,需要的CO2气体用下图中的装置A来制备.优点是可随用随停.如图中的装置B、C、D中与A具有相同工作原理也可制备CO2气体的是___(填写字母).

Ⅱ.制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题:
方案一:把一定质量的样品溶解后加入过量的CaCL2溶液,将所得沉淀___(填操作名称)、洗涤、烘干、称量、计算、洗涤沉淀的具体操作是___
方案二:把一定量的样品与足量硫酸反应后,用如图1所示装置测定产生CO2的体积,为了确保测定结果的准确性,B中的溶液最好采用___.如图装置中实验仪器a的名称是___.

方案三:利用如图2所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:
①按图连接装置,并检查气密性;
②准备称得盛有碱石灰的干燥管D的质量为33.4g;
③准备称得6g纯碱样品放入容器b中;
④打开分液漏斗a的胶塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为35.6g.
(1)若④⑤两步的实验操作太快,则会导致测定结果___(填“偏大”或“偏小”).
(2)装置A中试剂X应选用___.
(3)E装置的作用是___.
(4)根据实验中测得的有关数据,计算出纯碱样品Na2CO3的质量百分数为___(结果保留一位小数).
▼优质解答
答案和解析
Ⅰ、装置A用弹簧夹夹住橡胶管时气体排不出去,反应容器中的气体压强变大从而迫使稀盐酸与大理石分离,反应停止;放开弹簧夹时,稀盐酸与大理石接触,发生化学反应生成二氧化碳;
装置B中大理石与盐酸无法完全分离,所以不能达到随用随停,故不符合;
装置C中用弹簧夹夹住橡胶管时气体排不出去,球形瓶中的气体压强变大从而迫使稀盐酸排出干燥管并与大理石分离,反应停止.放开弹簧夹时,稀盐酸进入干燥管,并和烧杯中的液面相平同时与大理石接触,发生化学反应.所以该装置可以通过控制弹簧夹来达到使盐酸和大理石分离,从而控制反应的发生和停止,故符合;
装置D中大理石与盐酸无法分离,所以不能达到随用随停,故不符合;
故答案为:C;
II、方案一:样品溶解后加入过量的CaCl2溶液会生成碳酸钙沉淀,分离固液混合物的方法为过滤,洗涤沉淀的操作是沿玻璃棒缓慢地向过滤器中加蒸馏水至浸没沉淀物,使水自然流下,重复操作2-3次;
故答案为:过滤;沿玻璃棒缓慢地向过滤器中加蒸馏水至浸没沉淀物,使水自然流下,重复2~3次;
方案二:把一定量的样品与足量硫酸反应后,然后用如图装置测定产生的CO2气体的体积,是利用排液法测定生成二氧化碳的气体体积,在饱和碳酸氢钠溶液中二氧化碳不反应,溶解度最小,所以B中的溶液最好采用饱和NaHCO3溶液;由装置图可知下图装置中实验仪器a为圆底烧瓶;
故答案为:饱和NaHCO3溶液;圆底烧瓶;
方案三:(1)反应过快会使产生的气体二氧化碳没能完全被D装置中碱石灰吸收;快速鼓入空气,也会使装置内残留二氧化碳不能被D装置中碱石灰完全吸收;则测得的二氧化碳质量偏小,所以测定结果偏小;
故答案为:偏小;
(2)鼓入空气,可把残留在装置B、C中二氧化碳全部由D中碱石灰吸收,因为空气中含有二氧化碳,因此应把鼓入的空气中的二氧化碳吸收处理,所以装置A应放入氢氧化钠溶液;
故答案为:NaOH溶液;
(3)如果D装置直接与外界空气相连通,则空气中的水和二氧化碳会对测定结果带来影响,所以装置E的作用则是防止空气中水和二氧化碳进入装置D中;
故答案为:防止空气中CO2和水蒸气进入D中;
(4)反应中放出二氧化碳气体的质量=85.6g-83.4g=2.2g
设放出2.2g二氧化碳消耗碳酸钠的质量为x
Na2CO3~CO2
106 44
x 2.2g
=
,解得 x=5.3g
纯碱样品Na2CO3的质量分数=
×100%≈88.3%
故答案为:88.3%.
装置B中大理石与盐酸无法完全分离,所以不能达到随用随停,故不符合;
装置C中用弹簧夹夹住橡胶管时气体排不出去,球形瓶中的气体压强变大从而迫使稀盐酸排出干燥管并与大理石分离,反应停止.放开弹簧夹时,稀盐酸进入干燥管,并和烧杯中的液面相平同时与大理石接触,发生化学反应.所以该装置可以通过控制弹簧夹来达到使盐酸和大理石分离,从而控制反应的发生和停止,故符合;
装置D中大理石与盐酸无法分离,所以不能达到随用随停,故不符合;
故答案为:C;
II、方案一:样品溶解后加入过量的CaCl2溶液会生成碳酸钙沉淀,分离固液混合物的方法为过滤,洗涤沉淀的操作是沿玻璃棒缓慢地向过滤器中加蒸馏水至浸没沉淀物,使水自然流下,重复操作2-3次;
故答案为:过滤;沿玻璃棒缓慢地向过滤器中加蒸馏水至浸没沉淀物,使水自然流下,重复2~3次;
方案二:把一定量的样品与足量硫酸反应后,然后用如图装置测定产生的CO2气体的体积,是利用排液法测定生成二氧化碳的气体体积,在饱和碳酸氢钠溶液中二氧化碳不反应,溶解度最小,所以B中的溶液最好采用饱和NaHCO3溶液;由装置图可知下图装置中实验仪器a为圆底烧瓶;
故答案为:饱和NaHCO3溶液;圆底烧瓶;
方案三:(1)反应过快会使产生的气体二氧化碳没能完全被D装置中碱石灰吸收;快速鼓入空气,也会使装置内残留二氧化碳不能被D装置中碱石灰完全吸收;则测得的二氧化碳质量偏小,所以测定结果偏小;
故答案为:偏小;
(2)鼓入空气,可把残留在装置B、C中二氧化碳全部由D中碱石灰吸收,因为空气中含有二氧化碳,因此应把鼓入的空气中的二氧化碳吸收处理,所以装置A应放入氢氧化钠溶液;
故答案为:NaOH溶液;
(3)如果D装置直接与外界空气相连通,则空气中的水和二氧化碳会对测定结果带来影响,所以装置E的作用则是防止空气中水和二氧化碳进入装置D中;
故答案为:防止空气中CO2和水蒸气进入D中;
(4)反应中放出二氧化碳气体的质量=85.6g-83.4g=2.2g
设放出2.2g二氧化碳消耗碳酸钠的质量为x
Na2CO3~CO2
106 44
x 2.2g
| 106 |
| x |
| 44 |
| 2.2g |
纯碱样品Na2CO3的质量分数=
| 5.3g |
| 6g |
故答案为:88.3%.
看了硫酸钠与工农业生产、生活紧密相...的网友还看了以下:
下列各组溶液,不用其他试剂,就可以将它们区别开来的是()A.盐酸,氢氧化钠,碳酸钠,硫酸钠B.盐酸, 2020-03-31 …
亚硫酸钠(Na2SO3)是一种重要的化工原料,大量用于染料工业.亚硫酸钠中硫元素的化合价是()A. 2020-05-13 …
单质硫和氢氧化钠反应时会生成硫化钠(Na2S)和亚硫酸钠(Na2SO3).在硫化钠和亚硫酸钠中,钠 2020-05-13 …
(2012•佛山)连二亚硫酸钠(Na2S2O4),也称保险粉,广泛用于纺织工业,属于一级遇湿易燃物 2020-05-13 …
将4.6g钠与1.6g硫粉迅速混合起来,并放在石棉网上加热,反应后生成的固体是A.硫化钠B.硫粉与 2020-06-18 …
为什么硫酸不足生成碳酸氢钠和硫酸钠 硫酸过量生成硫酸钠和二氧化碳为什么硫酸不足生成碳酸氢钠和硫酸钠 2020-06-27 …
连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂.工业常用惰性电极电解亚硫酸氢钠的方法制备 2020-06-29 …
取15克含有杂质氯化钠的硫酸钠样品,投入到108.3克氯化钡溶液中恰好完全反应,过滤,洗涤,干燥, 2020-06-29 …
焦亚硫酸钠、亚硫酸氢钠、亚硫酸钠、连二亚硫酸钠、硫代硫酸钠,还原性比较.理论依据. 2020-07-11 …
工业上用Na2SO3和硫磺粉就是工业上用亚硫酸钠和硫磺粉在水溶液中加热进行反应制取硫代硫酸钠但在混 2020-07-12 …