早教吧作业答案频道 -->化学-->
低碳生活是一种时尚的生活理念,如何有效地开发利用碳资源以及降低大气中CO2的含量的研究显得更加紧迫.(1)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),
题目详情
低碳生活是一种时尚的生活理念,如何有效地开发利用碳资源以及降低大气中CO2的含量的研究显得更加紧迫.
(1)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生 成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
①请结合上表数据,写出NO与活性炭反应的化学方程式___.
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1=___,
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)___.
a.T1>T2 b.T1<T2 c.无法比较
(2)CO2在实验室常用氢氧化钠来吸收,现有8.96L CO2(标态),若用200ml 3mol/LNaOH 溶液将其恰好完全吸收,反应的离子方程式为___,所得溶液中离子浓度由大到小的顺序为___.
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.现将浓度为2×10-4
mo1/L Na2CO3溶液与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为___.
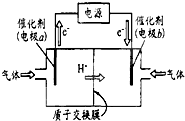
(4)若用如右图装置,以CO2和H2为原料制备甲醇,发生 反应为CO2+3H2
CH3OH+H2O,则b电极的电极反应为___.

(1)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生 成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
物质T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1=___,
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)___.
a.T1>T2 b.T1<T2 c.无法比较
(2)CO2在实验室常用氢氧化钠来吸收,现有8.96L CO2(标态),若用200ml 3mol/LNaOH 溶液将其恰好完全吸收,反应的离子方程式为___,所得溶液中离子浓度由大到小的顺序为___.
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.现将浓度为2×10-4
mo1/L Na2CO3溶液与等体积的CaCl2溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为___.
(4)若用如右图装置,以CO2和H2为原料制备甲醇,发生 反应为CO2+3H2
| ||
▼优质解答
答案和解析
(1)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2,且该反应为可逆反应,故反应方程式为:C+2NO⇌N2+CO2,
故答案为:C+2NO⇌N2+CO2;
②Ⅰ、平衡时c(NO)=
=0.02mol/L,c(N2)=c(CO2)=
=0.015mol/L,故T1℃时该反应的平衡常数为K1=
=
,故答案为:
;
Ⅱ、由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,无法判断温度变化,故答案为:c;
(2)根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠,标准状况下8.96L CO2是0.4mol,0.4molCO2和200mL 3mol/L NaOH溶液混合,二者的物质的量之比是2:3,所的溶液是碳酸钠和碳酸氢钠的混合物离子方程式为:2CO2+3OH-=HCO3-+CO32-+H2O;混合物显碱性c(OH-)>c(H+),碳酸根离子水解程度大与碳酸氢根离子的水解程度,所以c(CO32-)<c(HCO3-),即c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:2CO2+3OH-=HCO3-+CO32-+H2O;c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(3)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=
×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,c(Ca2+)=
mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L.
故答案为:5.6×10-5mol/L;
(4)据电子移动方向分析,b为阴极,阴极发生还原反应,CO2在阴极发生还原反应,电极反应式为:CO2+6H++6e-=CH3OH+H2O,故答案为:CO2+6H++6e-=CH3OH+H2O.
故答案为:C+2NO⇌N2+CO2;
②Ⅰ、平衡时c(NO)=
| 0.04mol |
| 2L |
| 0.03mol |
| 2L |
| 0.015×0.015 |
| 0.022 |
| 9 |
| 16 |
| 9 |
| 16 |
Ⅱ、由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,无法判断温度变化,故答案为:c;
(2)根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠,标准状况下8.96L CO2是0.4mol,0.4molCO2和200mL 3mol/L NaOH溶液混合,二者的物质的量之比是2:3,所的溶液是碳酸钠和碳酸氢钠的混合物离子方程式为:2CO2+3OH-=HCO3-+CO32-+H2O;混合物显碱性c(OH-)>c(H+),碳酸根离子水解程度大与碳酸氢根离子的水解程度,所以c(CO32-)<c(HCO3-),即c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:2CO2+3OH-=HCO3-+CO32-+H2O;c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(3)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=
| 1 |
| 2 |
| 2.8×10-9 |
| 1×10-4 |
故答案为:5.6×10-5mol/L;
(4)据电子移动方向分析,b为阴极,阴极发生还原反应,CO2在阴极发生还原反应,电极反应式为:CO2+6H++6e-=CH3OH+H2O,故答案为:CO2+6H++6e-=CH3OH+H2O.
看了低碳生活是一种时尚的生活理念,...的网友还看了以下:
回答第2小题中的A就好常温常压下1体积水约溶解1体积二氧化碳气体,氢氧化钠溶液与二氧化碳反应时没有 2020-04-26 …
为研究黄铜(铜锌合金)的组成,某学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再 2020-05-02 …
向1号试管滴2滴肝脏研磨液,向2号试管滴2滴氯化铁溶液如下图:(1)轻轻振荡二支试管时要试管口,以 2020-05-12 …
据科学家研究,高度每增加1千米,气温就会下降6摄氏度.A海拔6000米,气温-20摄氏度;B海拔1 2020-05-13 …
《游山西村》一诗描绘了(1)的气象和(2《游山西村》一诗描绘了(1)的气象和(2),刻画了农民(3 2020-05-13 …
由冰铜(mCu2O·nFeS)冶炼得到粗铜,再以粗铜为原料制纯铜的流程如下:请回答下列问题:(1) 2020-05-13 …
为研究二氧化碳的性质,某同学在实验室采用如图所示装置实验时,接触到下面一些问题:(1)A装置的气密 2020-05-13 …
(1)实验室电解饱和食盐水时发生反应的化学方程式为2NaCl+2H2O通电.2NaOH+H2↑+C 2020-05-14 …
最近,我国某物理研究所取得重大科技成果,研制出由18O所形成的单质气体.18O是一种稳定的同位素, 2020-05-14 …
最近,我国某物理研究所取得重大科技成果,研制出由18O所形成的单质气体.18O是一种稳定的同位素, 2020-05-14 …