25℃时,向盛有50mLpH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述正确的是()A.HA溶液的物质的量浓度为
25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述正确的是( )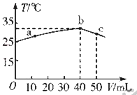
A. HA溶液的物质的量浓度为0 0l mol.L-1
B. b→c的过程中,温度降低的原因是溶液中发生了吸热反应
C. a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+)
D. 25℃时,HA的电离平衡常数K约为1.43×10-2
| 0.004mol |
| 0.05L |
B.b→c的过程中,温度降低的原因是溶液中发生了反应恰好生成NaA,继续滴加氢氧化钠溶液不再发生反应,溶液温度降低,故B错误;
C.NaA呈碱性,HA呈酸性,a→b的过程中,混合溶液中可能呈中性,存在:c(A-)=c(Na+),故C正确;
D.电离平衡常数K=
| c(H+)c(A-) |
| c(HA) |
| 0.01mol/L×0.01mol/L |
| 0.08mol/L-0.01mol/L |
故答案选C.
有关物质的量浓度溶液配制的下列说法中正确的是A把1摩尔氯化钠溶入1L水中所得溶液物质的量浓度为1摩 2020-04-12 …
关于溶液物质的量浓度的说法中,正确的是()A将40gNaOH溶入2L水中,c=0.5mol/LB在 2020-04-12 …
20度140g盐M的溶液,若蒸发掉40g水或加入10g盐M,溶液均可达到饱和状态,则原溶液中M的质 2020-04-26 …
厉害的请进来啊某固体物质M由下列离子中的部分离子组成:Cu2+,Ca2+,Ba2+,Na+,HCO 2020-06-14 …
现有质量和初温相等的M、N两块金属块,先将M放入一杯开水中,热平衡后,水温下降10℃,把M捞出后, 2020-07-12 …
小明为探究金属与盐的反应,将一定质量的金属粉末M放入AgNO3与Cu(NO3)2的混合溶液中,充分 2020-07-15 …
如图为物质W(不含结晶水)的溶解度曲线.M、N两点分别表示含物质W的两种溶液,下列说法正确的是() 2020-07-26 …
探究加速度与力质量的关系实验为什么m远小于m浪了一个寒假忘的差不多了对小车:T=Ma得到a=T/M, 2020-11-01 …
已知金属M能与稀硫酸反应产生氢气,实验中将一定质量的金属M投入到足量的稀硫酸中,查找资料与实验过程中 2020-12-30 …
是关于溶解度问题的先问下溶解度的计算公式是什么?我讲义上写:m溶质/m溶剂=S/100m溶质/m溶液 2021-01-14 …