早教吧作业答案频道 -->化学-->
Ti、Fe、Cu、Ni为过渡金属元素,在工业生产中有重要的应用.(1)Ti(BH4)2是一种重要的储氢材料.在基态Ti2+中,电子占据的最高能层符号为,该能层具有的原子轨道数为.(2)①Fe
题目详情
 Ti、Fe、Cu、Ni为过渡金属元素,在工业生产中有重要的应用.
Ti、Fe、Cu、Ni为过渡金属元素,在工业生产中有重要的应用.(1)Ti(BH4)2是一种重要的储氢材料.在基态Ti2+中,电子占据的最高能层符号为 ___,该能层具有的原子轨道数为 ___.
(2)①Fe、Fe2+都能被硝酸氧化.HNO3中氮原子轨道的杂化类型为 ______.
②常温下Fe(CO)5呈液态,熔点为-20.5℃,沸点为103℃.据此可以判断其晶体的类型为 ___,Fe(CO)5中铁的化合价为0,则该物质中含有的化学键类型有 ___(填字母).
A.离子键B.极性共价键C.非极性共价键D.配位键
③NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数 ___.
④NiO、FeO的晶体结构类型均与氧化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO ___FeO(填“<”或“>”).
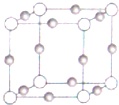
(3)Cu、N两元素形成某种化合物的晶胞结构如图,则其化学式为 ______(灰色球表示Cu原子),已知紧邻的白球与灰球之间的距离为a cm,该晶胞的密度为 ______g•cm-3.
▼优质解答
答案和解析
(1)在基态Ti2+中,核外电子排布为1s22s22p63s23p63d2,电子占据的最高能层符号为M,该能层具有的原子轨道数为9,故答案为:M;9;
(2)①HNO3中氮原子价层电子对数为3+
=3,N原子轨道的杂化类型为sp2,故答案为:sp2;
②在常温下Fe(CO)5呈液态,熔点和沸点较低,是分子晶体具备的性质,故属于分子晶体;在Fe(CO)5化合物中含有的化学键类型为:碳原子和氧原子之间的极性共价键,铁元素和羰基之间形成配位键,故答案为:分子晶体;BD;
③在此配合物中配位体位由1个NO和5个H2O分子构成,故该配合物中心离子的配位数为6,故答案为:6;
④Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高,由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO,故答案为:>;
(3)晶胞中Cu原子数目=12×
=3、N原子数目=8×
=1,故化学式为:Cu3N,晶胞的质量=(64×3+14)÷NA g,紧邻的白球与黑球之间的距离为a cm,则晶胞棱长=2a cm,则晶胞体积=(2a cm)3,故晶体的密度=[(64×3+14)÷NA]÷(2a cm)3=
g/cm3,
故答案为:Cu3N;
.
(2)①HNO3中氮原子价层电子对数为3+
| 5+1-2×3 |
| 2 |
②在常温下Fe(CO)5呈液态,熔点和沸点较低,是分子晶体具备的性质,故属于分子晶体;在Fe(CO)5化合物中含有的化学键类型为:碳原子和氧原子之间的极性共价键,铁元素和羰基之间形成配位键,故答案为:分子晶体;BD;
③在此配合物中配位体位由1个NO和5个H2O分子构成,故该配合物中心离子的配位数为6,故答案为:6;
④Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高,由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO,故答案为:>;
(3)晶胞中Cu原子数目=12×
| 1 |
| 4 |
| 1 |
| 8 |
| 103 |
| 4NA•a3 |
故答案为:Cu3N;
| 103 |
| 4NA•a3 |
看了Ti、Fe、Cu、Ni为过渡金...的网友还看了以下:
A、B、C、D为短周期元素,核电荷数依次增大,且A、B、C三种元素的原子核外电子层数之和为5。已知 2020-04-08 …
现有部分元素的存在、性质或原子结构如表所示:A最外层电子数是次外层电子数的2倍的元素B最高正价为+ 2020-04-08 …
最外层电子数与电子层数的关系原子的电子数与电子层数有什么数量关系?我所指的是最外层电子数最多的情况 2020-04-25 …
在核电荷数为1-18的元素,原子最外层电子数等于次外层电子数的有 1种 2种 3种 4种 2020-05-16 …
把一张纸对折层数的规律当你把纸对折1次,可以得到2层;当对折2次时,可以得到4层;当对折3次时,可 2020-05-23 …
一个书架有两层,上层数的本书是下层的四分之三,若从下层那8本到上层,则两层的书一样多,这个书架共有 2020-06-05 …
电梯安装工程中,站数与层数的关系为( )。 A.站数必须等于层数B.站数大于、小于层数均可C. 2020-06-07 …
电梯安装工程中,站数与层数的关系为( )。 A.站数必须等于层数 B.站数大于、小于层数 2020-06-07 …
化学怎么看电子层数一开始老师是说最外层电子层数做多是8后来居然出现第三层是18的我想知道怎么算第三 2020-06-08 …
X、Y、Z、W是四种短周期元素,X原子M层上的电子数是原子核外电子层数的2倍;Y原子最外层电子数是 2020-06-12 …