早教吧作业答案频道 -->化学-->
主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道
题目详情
主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子.
(1)五种元素中第一电离能最小的是___.电负性最大的是___(填元素符号).
(2)Y元素原子的价层电子的电子排布图为___,该元素的名称是___.气态分子YM2的立体构型___,YM2可形成多聚体(YM2)n的原因是___.
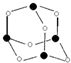
(3)Z和N形成分子W的结构如图所示,化合物W的分子式为___,Z、N原子的杂化类型分别为___、___.
(4)已知化合物NX3是剧毒的气体,与AgNO3溶液反应有黑色Ag析出,同时生成W,此反应是检验微量NX3的方法,该反应的化学方程式是___.
(5)画出配离子YZ4X42-的结构式___,1mol该离子中含有的共价键数目为___.

(1)五种元素中第一电离能最小的是___.电负性最大的是___(填元素符号).
(2)Y元素原子的价层电子的电子排布图为___,该元素的名称是___.气态分子YM2的立体构型___,YM2可形成多聚体(YM2)n的原因是___.
(3)Z和N形成分子W的结构如图所示,化合物W的分子式为___,Z、N原子的杂化类型分别为___、___.
(4)已知化合物NX3是剧毒的气体,与AgNO3溶液反应有黑色Ag析出,同时生成W,此反应是检验微量NX3的方法,该反应的化学方程式是___.
(5)画出配离子YZ4X42-的结构式___,1mol该离子中含有的共价键数目为___.
▼优质解答
答案和解析
主族元素X、Y、Z、M、N的原子序数依次增大,Y原子的各能层电子数相同,核外电子排布为1s22s2,则Y为Be;Z原子最外层电子数是次外层的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素;N元素原子的4p轨道上有3个未成对电子,外围电子排布为4s24p3,则N为As元素;X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,则X为H元素、M为Cl.
(1)五种元素中只有Be为金属元素,其第一电离能最小,氧元素与H、Cl、As形成的化合物中O表现负价,故O元素电负性最大,
故答案为:Be;O;
(2)Y元素原子核外电子排布为1s22s2,价层电子的电子排布图为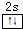 ,该元素的名称是铍.气态分子BeCl2中Be原子形成2个Be-Cl键,没有孤电子对,故为直线型结构,BeCl2可形成多聚体(YM2)n的原因是:BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键,
,该元素的名称是铍.气态分子BeCl2中Be原子形成2个Be-Cl键,没有孤电子对,故为直线型结构,BeCl2可形成多聚体(YM2)n的原因是:BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键,
故答案为: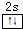 ;BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键;
;BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键;
(3)由分子W的结构图可知,该分子为A3B6型,故化合物W的分子式为As4O6,黑色球为As,白色球为O,O原子形成2个σ键,有2对孤对电子,轨道杂化数为4,O原子采取sp3杂化,As原子形成3个σ键,孤对电子w为
=1,轨道杂化数为4,As原子采取sp3杂化,
故答案为:As4O6;sp3;sp3;
(4)已知化合物AsX3是剧毒的气体,与AgNO3溶液反应有黑色Ag析出,同时生成As4O6,此反应是检验微量PX3的方法,该反应的化学方程式是:4AsH3+24AgNO3+6H2O=As4O6+24Ag↓+24HNO3,
故答案为:4AsH3+24AgNO3+6H2O=As4O6+24Ag↓+24HNO3;
(5)配离子YZ4X42-为[Be(OH)4]2-,Be2+提供空轨道,OH-提供孤对电子,其结构式为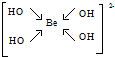 ,Be2+与OH-形成4个配位键、OH-中存在O-H键,1mol该离子中含有的共价键为8mol,含有共价键数目为8NA,
,Be2+与OH-形成4个配位键、OH-中存在O-H键,1mol该离子中含有的共价键为8mol,含有共价键数目为8NA,
故答案为: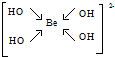 ;8NA.
;8NA.
(1)五种元素中只有Be为金属元素,其第一电离能最小,氧元素与H、Cl、As形成的化合物中O表现负价,故O元素电负性最大,
故答案为:Be;O;
(2)Y元素原子核外电子排布为1s22s2,价层电子的电子排布图为
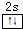 ,该元素的名称是铍.气态分子BeCl2中Be原子形成2个Be-Cl键,没有孤电子对,故为直线型结构,BeCl2可形成多聚体(YM2)n的原因是:BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键,
,该元素的名称是铍.气态分子BeCl2中Be原子形成2个Be-Cl键,没有孤电子对,故为直线型结构,BeCl2可形成多聚体(YM2)n的原因是:BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键,故答案为:
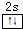 ;BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键;
;BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键;(3)由分子W的结构图可知,该分子为A3B6型,故化合物W的分子式为As4O6,黑色球为As,白色球为O,O原子形成2个σ键,有2对孤对电子,轨道杂化数为4,O原子采取sp3杂化,As原子形成3个σ键,孤对电子w为
| 5-1×3 |
| 2 |
故答案为:As4O6;sp3;sp3;
(4)已知化合物AsX3是剧毒的气体,与AgNO3溶液反应有黑色Ag析出,同时生成As4O6,此反应是检验微量PX3的方法,该反应的化学方程式是:4AsH3+24AgNO3+6H2O=As4O6+24Ag↓+24HNO3,
故答案为:4AsH3+24AgNO3+6H2O=As4O6+24Ag↓+24HNO3;
(5)配离子YZ4X42-为[Be(OH)4]2-,Be2+提供空轨道,OH-提供孤对电子,其结构式为
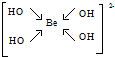 ,Be2+与OH-形成4个配位键、OH-中存在O-H键,1mol该离子中含有的共价键为8mol,含有共价键数目为8NA,
,Be2+与OH-形成4个配位键、OH-中存在O-H键,1mol该离子中含有的共价键为8mol,含有共价键数目为8NA,故答案为:
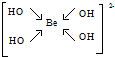 ;8NA.
;8NA.
看了主族元素X、Y、Z、M、N的原...的网友还看了以下:
W、X、Y、Z、R属于短周期元素.已知它们都不是稀有气体元素,W的原子半径是短周期中最大,X元素的 2020-04-08 …
下列叙述中正确的是()A.除零族元素外,短周期元素原子的最外层电子数等于该元素所属的族序数B.除短 2020-04-08 …
短周期原子序数依次递增的A、B、C、D、E、F六种元素,已知B原子最外层电子数是A原子次外层电子数 2020-04-08 …
A、B、C、D、E、F属于短周期主族元素.A的原子半径在短周期中最大,B的一种原子中,质量数与质子 2020-04-08 …
(2011•合肥三模)A、B、C、D、E、F属于短周期主族元素.A的原子半径在短周期中最大,B元素 2020-05-14 …
元素周期表中电负性最大的元素是,最小的是.(放射性金属除外);第二、三、四周期原子中p轨道半充满的 2020-06-09 …
已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素.其中A是元素周期表中原子半径 2020-07-20 …
氧原子半径为什么比氟大氧原子半径为什么比氟原子大?O的电子有两层,最外层6电子.F的电子也有两层, 2020-07-29 …
为啥同一周期原子序数越大,原子半径越小,想不通?同一周期,电子层数相同,而最外层电子数增多,但是原子 2020-11-17 …
(2014•蓟县一模)[物质结构与性质]有A、B、C、D、E、F、G七种元素,试按下述所给的条件推断 2020-12-21 …