早教吧作业答案频道 -->化学-->
高锰酸钾在不同的条件下发生的反应如下:①MnO4-+5e-+8H+═Mn2++4H2O②MnO4-+3e-+2H2O═MnO2↓+4OH-③MnO4-+e-═MnO42-(溶液绿色)(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的
题目详情
高锰酸钾在不同的条件下发生的反应如下:
①MnO4-+5e-+8H+═Mn2++4H2O
②MnO4-+3e-+2H2O═MnO2↓+4OH-
③MnO4-+e-═MnO42-(溶液绿色)
(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的___影响.
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为___→___.
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色.下列说法正确的是___
a.氧化性:PbO2>KMnO4
b.还原性:PbO2>KMnO4
c.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到强碱性硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3:2,完成下列化学方程式(横线上填系数,括号内填物质),并用单线桥法表示电子的转移情况.
①___KMnO4+___K2S+___═___K2MnO4+___K2SO4+___S↓+___.
②若生成6.4g单质硫,反应过程中转移电子数为___.
(5)已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
MnO4-→Mn2+; Fe3+→Fe2+; IO3-→I2; HNO3→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是___
a.MnO4- b.Fe3+c.IO3-d.HNO3.
①MnO4-+5e-+8H+═Mn2++4H2O
②MnO4-+3e-+2H2O═MnO2↓+4OH-
③MnO4-+e-═MnO42-(溶液绿色)
(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的___影响.
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为___→___.
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色.下列说法正确的是___
a.氧化性:PbO2>KMnO4
b.还原性:PbO2>KMnO4
c.该反应可以用盐酸酸化
(4)将高锰酸钾逐滴加入到强碱性硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3:2,完成下列化学方程式(横线上填系数,括号内填物质),并用单线桥法表示电子的转移情况.
①___KMnO4+___K2S+___═___K2MnO4+___K2SO4+___S↓+___.
②若生成6.4g单质硫,反应过程中转移电子数为___.
(5)已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
MnO4-→Mn2+; Fe3+→Fe2+; IO3-→I2; HNO3→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是___
a.MnO4- b.Fe3+c.IO3-d.HNO3.
▼优质解答
答案和解析
(1)根据反应式知,不同环境中反应后的离子颜色不同,溶液的酸碱性不同溶液的颜色不同,所以溶液的颜色受溶液酸碱性的影响,故答案为:酸碱性;
(2)二氧化硫含有还原性,酸性条件下,高锰酸根离子得电子生成二价锰离子,所以高锰酸根离子有强氧化性,所以还原反应的过程为MnO4-→Mn2+,
故答案为:MnO4-;Mn2+;
(3)同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性,将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色,说明PbO2氧化二价锰离子生成高锰酸根离子,所以PbO2作氧化剂,高锰酸根离子是氧化产物,所以PbO2的氧化性大于高锰酸根离子,故选a;
(4)该反应中,高锰酸钾是氧化剂,一个高锰酸钾化学式得1个电子,硫化钾是还原剂,K2SO4和S的物质的量之比为3:2,所以硫化钾生成硫酸钾和硫单质失去的电子数是28个电子,所以得失电子的最小公倍数是28,所以高锰酸钾的计量数是28,硫化钾的计量数是5,其它元素根据原子个数相等配平,所以方程式为:28KMnO4+5K2S+24KOH=28K2MnO4+3K2SO4+2S↓+12H2O,用单线桥法表示电子的转移为: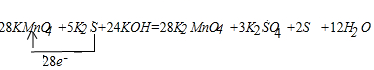
若生成6.4 g单质硫,设转移电子数是x,依据化学方程式定量关系计算
28KMnO4+5K2S+24KOH=28K2MnO4+3K2SO4+2S↓+12H2O 转移电子
2mol 28mol
2.8mol
故答案为:①28、5、24KOH、28、3、2、12H2O;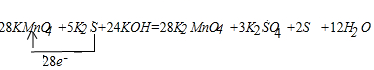 ②2.8mol;
②2.8mol;
(5)由氧化还原反应中得失电子守恒,1mol氧化剂得电子越多,生成的I2就多;
a、1molMnO4-→Mn2+得5mole-,
b、1molFe3+→Fe2+得1mole-,
c、1molIO3-→I2得5mole-,
d、1molHNO3→NO得1mole-;
且IO3-的还原产物也为碘,则c中生成的I2就最多,
故选c.
(2)二氧化硫含有还原性,酸性条件下,高锰酸根离子得电子生成二价锰离子,所以高锰酸根离子有强氧化性,所以还原反应的过程为MnO4-→Mn2+,
故答案为:MnO4-;Mn2+;
(3)同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性,将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色,说明PbO2氧化二价锰离子生成高锰酸根离子,所以PbO2作氧化剂,高锰酸根离子是氧化产物,所以PbO2的氧化性大于高锰酸根离子,故选a;
(4)该反应中,高锰酸钾是氧化剂,一个高锰酸钾化学式得1个电子,硫化钾是还原剂,K2SO4和S的物质的量之比为3:2,所以硫化钾生成硫酸钾和硫单质失去的电子数是28个电子,所以得失电子的最小公倍数是28,所以高锰酸钾的计量数是28,硫化钾的计量数是5,其它元素根据原子个数相等配平,所以方程式为:28KMnO4+5K2S+24KOH=28K2MnO4+3K2SO4+2S↓+12H2O,用单线桥法表示电子的转移为:
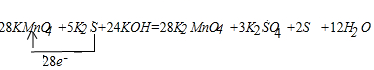
若生成6.4 g单质硫,设转移电子数是x,依据化学方程式定量关系计算
28KMnO4+5K2S+24KOH=28K2MnO4+3K2SO4+2S↓+12H2O 转移电子
2mol 28mol
| 6.4g |
| 32g/mol |
故答案为:①28、5、24KOH、28、3、2、12H2O;
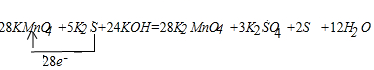 ②2.8mol;
②2.8mol;(5)由氧化还原反应中得失电子守恒,1mol氧化剂得电子越多,生成的I2就多;
a、1molMnO4-→Mn2+得5mole-,
b、1molFe3+→Fe2+得1mole-,
c、1molIO3-→I2得5mole-,
d、1molHNO3→NO得1mole-;
且IO3-的还原产物也为碘,则c中生成的I2就最多,
故选c.
看了 高锰酸钾在不同的条件下发生的...的网友还看了以下:
帮忙写出下列化学变化的方程式~小女子在此谢过~1用高锰酸钾制取氧气的反应2氯酸钾在高锰酸钾的催化作 2020-05-13 …
用相应的符号、化学式填写在下列空格中:(1)两个硫酸根(2)三个氮原子(3)一个氢分子(4)+4价 2020-05-14 …
用数字和化学符合表示或写出下列符号表示的意义(1)锰酸钾中锰显+6价K2+6MnO4K2+6MnO 2020-05-14 …
3个化学离子=氯酸根离子高锰酸根离子锰酸根离子怎么表达?(例如SO4/2-)这样表达吧,起码我看的 2020-05-14 …
分子和原子的区分?如KMnO4,它是由一个钾原子、一个锰原子和4个氧原子组成的?为什么说两个氧原子 2020-06-04 …
4氧化锰离子锰的化学价怎么算 2020-06-14 …
高锰酸钾和草酸的反应高锰酸根,氢离子,锰离子,水的系数为什么不是1,8,1,4而是2,16,2,8 2020-06-14 …
在高锰酸钾分解制氧气的反应中,二氧化锰是物;在氯酸钾与二氧化锰混合加热制氧气时,氯酸钾是物,二氧化 2020-06-14 …
高锰酸钾的滴定问题高锰酸钾能滴定+2价的锰离子吗?高锰酸钾是氧化性的 但是我要滴定的溶液里边有还原 2020-06-27 …
锰结核主要分布在水深4-6公里的深海盆的海底,在东太平洋的克拉里昂断裂带与克里帕顿断裂带之间储量特 2020-07-10 …