早教吧作业答案频道 -->化学-->
某含氯化合物A由两种短周期元素组成,常温下该物质为气态,测得该气体对空气的相对密度为3.0(空气相对分子质量为29),A溶于水可得只含单一溶质的弱酸B的水溶液,B溶液在放置过程中
题目详情
某含氯化合物A由两种短周期元素组成,常温下该物质为气态,测得该气体对空气的相对密度为3.0(空气相对分子质量为29),A溶于水可得只含单一溶质的弱酸B的水溶液,B溶液在放置过程中(特别是光照下),其酸性会增强.常温下,气体A与NH3反应生成离子化合物C、气体单质D和常见液体E,D为空气中含量最多的物质.气体A可用某一气体单质与潮湿的Na2CO3 反应制得,同时生成两种钠盐.请回答下列问题:
(1)气体A的化学式为___,已知气体A中所有原子都满足8电子稳定结构,则A的电子式为___.
(2)气体A与NH3反应的化学方程式为___.
(3)试写出上述叙述中制取气体A的化学方程式为___.
将上述恰好完全反应后生成的两种钠盐的混合物溶于水形成溶液,关于该溶液下列关系式不正确的是___
A.c(Na+)=2c(HCO3-)+2c(H2CO3)+2c(CO32-)
B.c(OH-)+c(Cl-)=c(HCO3-)+2c(H2CO3)+c(H+)
C.c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)>c(H2CO3)
(4)图甲是镁与B的钠盐构成的原电池装置,反应过程中会产生白色沉淀;图乙是Cr2O72-的工业废水的模拟处理装置,其中Cr2O72-离子最终以Cr(OH)3的形式除去.
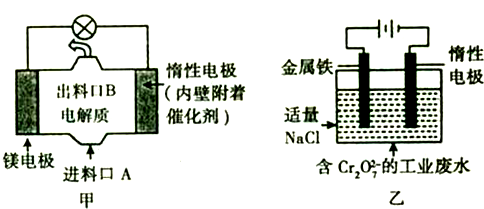
图甲中发生的电池总反应式为:___.若图甲中3.6g镁溶解产生的电量用以图乙废水的处理,则甲中的镁电极应与乙中___电极(“铁”或“惰性”)相连,理论上乙池中可产生___g Cr(OH)3沉淀.
(1)气体A的化学式为___,已知气体A中所有原子都满足8电子稳定结构,则A的电子式为___.
(2)气体A与NH3反应的化学方程式为___.
(3)试写出上述叙述中制取气体A的化学方程式为___.
将上述恰好完全反应后生成的两种钠盐的混合物溶于水形成溶液,关于该溶液下列关系式不正确的是___
A.c(Na+)=2c(HCO3-)+2c(H2CO3)+2c(CO32-)
B.c(OH-)+c(Cl-)=c(HCO3-)+2c(H2CO3)+c(H+)
C.c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)>c(H2CO3)
(4)图甲是镁与B的钠盐构成的原电池装置,反应过程中会产生白色沉淀;图乙是Cr2O72-的工业废水的模拟处理装置,其中Cr2O72-离子最终以Cr(OH)3的形式除去.

图甲中发生的电池总反应式为:___.若图甲中3.6g镁溶解产生的电量用以图乙废水的处理,则甲中的镁电极应与乙中___电极(“铁”或“惰性”)相连,理论上乙池中可产生___g Cr(OH)3沉淀.
▼优质解答
答案和解析
某含氯化合物A由两种短周期元素组成,气体A与NH3反应生成离子晶体C、气体单质D和常见液体E,D为空气中含量最多的物质,则D为N2,常见液体E为H2O,根据元素守恒可知,A为氯的氧化物,测得A气体对空气的相对密度为3.0,则其相对分子质量为3×29=87,故A分子中Cl原子数目为偶数,只能为2,则含有氧原子数目=
=1,故A为Cl2O,可推知离子化合物C为NH4Cl,A溶于水可得只含单一溶质B的弱酸性溶液,B溶液在放置过程中其酸性会增强,B为HClO,气体A可用某一气体单质与潮湿的Na2CO3反应制得,同时生成两种钠盐,由元素守恒可知,该单质气体为Cl2,生成的两种钠盐只能为NaHCO3、NaCl,
(1)由上述分析可知,气体A的化学式为Cl2O,A为共价化合物的电子式为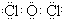
故答案为:Cl2O;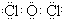 ;
;
(2)气体A与NH3反应的化学方程式为:3Cl2O+10NH3=6NH4Cl+2N2+3H2O,反应中Cl的化合价降低,该反应体现气体Cl2O具有氧化性,
故答案为:3Cl2O+10NH3=6NH4Cl+2N2+3H2O;
(3)Cl2与潮湿的碳酸钠反应生成Cl2O,同时生成的两种钠盐只能为NaHCO3、NaCl,化学方程式为:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl,将上述恰好完全反应后生成的两种钠盐NaHCO3、NaCl的混合物溶于水形成溶液显示碱性,碳酸氢根离子的水解程度大于电离程度,
A.根据物料守恒,得到c(Na+)>2c(HCO3-)+2c(H2CO3)+2c(CO32-),故A错误;
B.根据电荷守恒:c(OH-)+c(Cl-)=c(HCO3-)+2c(CO32-)+c(H+),故B错误;
C、等量的两种钠盐NaHCO3、NaCl的混合物中,碳酸氢根离子的水解程度大于电离程度,所以c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)>c(H2CO3)
,故C正确;故答案为:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl;C;
(4)该原电池中,镁作负极,负极上镁失电子发生氧化反应,负极反应为Mg-2e-=Mg2+,正极上次氯酸根离子得电子发生还原反应Mg+ClO-+H2O=Cl-+Mg(OH)2,电池反应式为两电极反应之和,即Mg+ClO-+H2O=Mg(OH)2↓+Cl-,甲中的镁电极是原电池的负极,应该和电源的负极相连,
由电子守恒可知,3Mg~6e-~3Fe2+,Cr2O72-~2Cr3+~2Cr(OH)3↓,则n(Mg)=
=0.15mol,消耗金属镁0.15mol,转移电子是0.3mol,此时得到的铬离子是0.1mol,产生沉淀是0.1mol×103g/mol=10.3g,故答案为:10.3g.
| 87-35.5×2 |
| 16 |
(1)由上述分析可知,气体A的化学式为Cl2O,A为共价化合物的电子式为
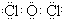
故答案为:Cl2O;
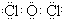 ;
;(2)气体A与NH3反应的化学方程式为:3Cl2O+10NH3=6NH4Cl+2N2+3H2O,反应中Cl的化合价降低,该反应体现气体Cl2O具有氧化性,
故答案为:3Cl2O+10NH3=6NH4Cl+2N2+3H2O;
(3)Cl2与潮湿的碳酸钠反应生成Cl2O,同时生成的两种钠盐只能为NaHCO3、NaCl,化学方程式为:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl,将上述恰好完全反应后生成的两种钠盐NaHCO3、NaCl的混合物溶于水形成溶液显示碱性,碳酸氢根离子的水解程度大于电离程度,
A.根据物料守恒,得到c(Na+)>2c(HCO3-)+2c(H2CO3)+2c(CO32-),故A错误;
B.根据电荷守恒:c(OH-)+c(Cl-)=c(HCO3-)+2c(CO32-)+c(H+),故B错误;
C、等量的两种钠盐NaHCO3、NaCl的混合物中,碳酸氢根离子的水解程度大于电离程度,所以c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)>c(H2CO3)
,故C正确;故答案为:2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl;C;
(4)该原电池中,镁作负极,负极上镁失电子发生氧化反应,负极反应为Mg-2e-=Mg2+,正极上次氯酸根离子得电子发生还原反应Mg+ClO-+H2O=Cl-+Mg(OH)2,电池反应式为两电极反应之和,即Mg+ClO-+H2O=Mg(OH)2↓+Cl-,甲中的镁电极是原电池的负极,应该和电源的负极相连,
由电子守恒可知,3Mg~6e-~3Fe2+,Cr2O72-~2Cr3+~2Cr(OH)3↓,则n(Mg)=
| 3.6g |
| 24g/mol |
看了 某含氯化合物A由两种短周期元...的网友还看了以下:
下列集合A到集合B的对应关系中,不能确定y是x的函数的是①A={x|x∈Z}B={y|y∈Z}对应关 2020-03-30 …
我是高一新生,下列集合A到集合B的对应关系中,不能确定y是x的函数的是:①A={x|x∈Z}B={y 2020-03-30 …
下列从集合A到集合B的对应关系中,不能确定Y是X的函数是请写明理由A={x|-1≤x≤1,x∈R}, 2020-03-30 …
下列集合A到集合B的对应关系中,不能确定y是x的函数的是1)A={X|X∈Z}B={y|y∈Z},对 2020-03-30 …
下列从集合A到集合B的对应关系中,不能确定Y是X的函数是请写明理由A=R,B=R,对应法则f:y=x 2020-03-30 …
英语PAS翻译英语一个比较专业的词组,请帮忙翻译成比较合适的中文,意思我知道,但是找不到合适的对应 2020-05-17 …
高岭土和沉淀硫酸钡有什么不同双方之间是否发生反应,以及两种物质的对比. 2020-05-17 …
人类改变地表的行为都是合理的.对吗? 2020-05-20 …
下列哪一项不属于财产保险合同的对象( )A.有形的物质财产B.派生的经济利益C.损害赔偿责任 2020-05-22 …
人工合成的对植物的生长发育有调节作用的化学物质称为. 2020-05-23 …