早教吧作业答案频道 -->化学-->
汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)催化剂2CO2(g)+N2(g).
题目详情
汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
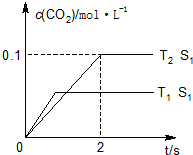
2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.据此判断:
①该反应的△H___0(填“>”“<”).
②在T2温度下,0~2s内的平均反应速率v(N2)=___.
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线.
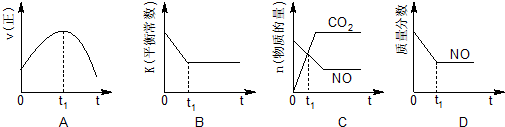
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是___(填代号).
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)和H2O(g)的热化学方程式___.
(3)已知反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),现将不同量的CO2(g)和H2(g)分别通入到容积为2L的恒容密闭容器中进行反应,得到如下两组数据:
①实验1条件下平衡常数K=___(保留小数点后二位).
②该反应的△H___0(填“<”或“>”).

(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
| 催化剂 |
| |
①该反应的△H___0(填“>”“<”).
②在T2温度下,0~2s内的平均反应速率v(N2)=___.
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线.
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是___(填代号).

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol
2NO2(g)═N2O4(g)△H=-56.9kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)和H2O(g)的热化学方程式___.
(3)已知反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),现将不同量的CO2(g)和H2(g)分别通入到容积为2L的恒容密闭容器中进行反应,得到如下两组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| CO2(g) | H2(g) | H2O(g) | CO2(g) | |||
| 1 | 650 | 2 | 1 | 0.4 | 1.6 | 6 |
| 2 | 900 | 4 | 2 | 1.6 | 2.4 | 2 |
②该反应的△H___0(填“<”或“>”).
▼优质解答
答案和解析
(1)①由图1可知,温度T1先到达平衡,故温度T1>T2,温度越高平衡时,二氧化碳的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应,
故答案为:<;
②由图可知,T2温度时2s到达平衡,平衡时二氧化碳的浓度变化量为0.1mol/L,故v(CO2)=
0.05mol/(L•s),速率之比等于化学计量数之比,故v(N2)=0.5v(CO2)=0.5×0.05mol/(L•s)=0.025mol/(L•s),
故答案为:0.025mol/(L•s);
③接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T1到达平衡时相同,故c(CO2)在T1、S2条件下达到平衡过程中的变化曲线为: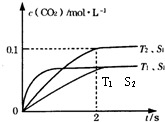 ,
,
故答案为: ;
;
④A.到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故A错误;
B.该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,故B正确,
C、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故C错误;
D、NO的质量分数为定值,t1时刻处于平衡状态,故D正确;
故答案为:BD;
(2)已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol①
2NO2(g)⇌N2O4(g)△H2=-56.9kJ/mol②
H2O(g)=H2O(l)△H=-44.0kJ/mol③
根据盖斯定律,①-②+④×2可得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(l),故△H=-867kJ/mol-(-56.9kJ/mol)+2(-44.0)kJ/mol=-898.1kJ/mol 即CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol,
故答案为:CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol;
(3)①平衡时CO2的物质的量为1.6mol,则:
CO(g)+H2O(g)⇌CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.6 0.6 1.6 1.6
平衡(mol):1.4 0.4 1.6 1.6
该反应前后气体体积不变,故利用物质的量代替浓度计算平衡常数,故650℃时该反应平衡常数k=
=4.57,
故答案为:4.57;
②实验1中CO2的转化率为
×100%=20%,实验2中CO2的转化率为
×100%=40%,则实验1的转化率小于实验2,则说明温度升高平衡向正反应方向移动,正反应吸热,故答案为:>.
故答案为:<;
②由图可知,T2温度时2s到达平衡,平衡时二氧化碳的浓度变化量为0.1mol/L,故v(CO2)=
| 0.1mol/L |
| 2s |
故答案为:0.025mol/(L•s);
③接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T1到达平衡时相同,故c(CO2)在T1、S2条件下达到平衡过程中的变化曲线为:
 ,
,故答案为:
 ;
;④A.到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故A错误;
B.该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,故B正确,
C、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故C错误;
D、NO的质量分数为定值,t1时刻处于平衡状态,故D正确;
故答案为:BD;
(2)已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol①
2NO2(g)⇌N2O4(g)△H2=-56.9kJ/mol②
H2O(g)=H2O(l)△H=-44.0kJ/mol③
根据盖斯定律,①-②+④×2可得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(l),故△H=-867kJ/mol-(-56.9kJ/mol)+2(-44.0)kJ/mol=-898.1kJ/mol 即CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol,
故答案为:CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol;
(3)①平衡时CO2的物质的量为1.6mol,则:
CO(g)+H2O(g)⇌CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.6 0.6 1.6 1.6
平衡(mol):1.4 0.4 1.6 1.6
该反应前后气体体积不变,故利用物质的量代替浓度计算平衡常数,故650℃时该反应平衡常数k=
| 1.6×1.6 |
| 1.4×0.4 |
故答案为:4.57;
②实验1中CO2的转化率为
| 2-1.6 |
| 2 |
| 4-2.4 |
| 4 |
看了汽车尾气、燃煤尾气、地面灰尘等...的网友还看了以下:
由金红石(TiO2)制取单质Ti,涉及的步骤为:已知:①C(s)+O2(g)====CO2(g)Δ 2020-04-07 …
已知:①C(s)+O2(g)=CO2(g);△H=-393.5kJ•mol1②2CO(g)+O2 2020-04-07 …
(1)氢气、甲醇是优质的清洁燃料,可制作燃料电池.已知:①2CH3OH(l)+3O2(g)═2CO 2020-04-07 …
目前工业上利用CO2来生产燃料甲醇,可将CO2变废为宝.Ⅰ.已知常温常压下:①CH3OH(l)+O 2020-04-07 …
钛(Ti)被称为继铁、铝之后的第三金属,已知由金红石(TiO2)制取单质Ti,涉及的步骤为:已知① 2020-04-07 …
现有下列热化学方程式:①C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1②2 2020-04-07 …
你能用1、5、6、0这四个数字按下列要求组成不同的三位数乘一位数的乘法算式吗?(1)积的末尾没有0 2020-05-13 …
你能用1、5、6、0这四个数字按下列要求组成不同的三位数乘一位数的乘法算式吗?(1)积的末尾没有0 2020-05-13 …
已知函数f(x)=sin(wx+π/3)(x∈R),且f(π/6)=1(1)求w的最小值及此时函数 2020-05-20 …
甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料.甲醇在各个领域有着广泛的应用.(1 2020-07-20 …