常温下取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3.且HA和HB的1L溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正
常温下取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3.且HA和HB的1L溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是( )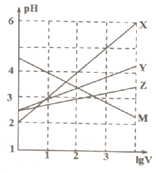
A. X是HA,M是HB
B. 常温下pH:NaA溶液>NaB溶液
C. 对于
的值(R代表A或B),一定存在HA>HBc(R-) c(HR)c(OH-)
D. 若常温下浓度均为0.1mol/L的NaA和HA的混合溶液的pH>7,则c(A-)>c(HA)
数学填空题的方程需要化简吗比如说可列方程这里的方程需要化简吗x(x+1)=1 2020-03-31 …
实验室可以通过乙醇分子内的脱水反应制乙烯,反应方程式如下:C2H5OH浓H2SO4170℃CH2= 2020-04-08 …
根据硝酸尾气处理的反应原理:2NO2+2NaOH=NaNO3+NaNO2+H2O NO+NO2+2 2020-05-16 …
已知2NO2+2NaOH==NaNO2+NaNO3+H2O ,NO+NO2+2NaOH==2NaN 2020-05-16 …
Na2S水解方程问题请问一下,如果题目要求我写出Na2S的水解方程我是应该答:Na2S=2Na++ 2020-06-02 …
下列有关化学平衡移动叙述,正确的是()ABCD可逆反应:Cr2O72-+H2O⇌2CrO42-+2 2020-07-02 …
屁溶于水后的反应是这样的么NH3+H2O=可逆反应=NH3.H2O=可逆反应=NH4++OH-H2 2020-07-03 …
已知2NO2+2NaOH==NaNO2+NaNO3+H2O,NO+NO2+2NaOH==2NaNO2 2020-11-01 …
(2007•宿迁二模)乙醇、液氨、水都可以发生自偶电离,如H2O+H2O⇌H3O++OH-,NH3+ 2020-11-12 …
化合物M具有广谱抗菌活性,合成M的反应可表示如下:+H2O下列说法正确的是()A.X分子中有2个手性 2020-11-22 …