已知H2SO3⇌HSO3-+H+,Ka1;HSO3-⇌SO32-+H+,Ka2.常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示
已知H2SO3⇌HSO3-+H+,Ka1;HSO3-⇌SO32-+H+,Ka2.常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )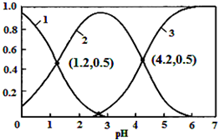
A. pH=1.2溶液中:c(Na+)+c(H+)═c(OH-)+c(H2SO3)
B. 常温下,
=1000c2(HSO3-) c(H2SO3)•c(SO32-)
C. 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度先增大后减小
D. 曲线3表示的微粒是SO32-
B.坐标(1.2,0.5)时H2SO3、HSO3-的含量相同,则Ka1=c(H+)=10-1.2,坐标(4.2,0.5)时HSO3-和SO32-的浓度相等,Ka2=c(H+)=10-4.2,常温下
| c(HSO3-) |
| c(H2SO3)c(SO32-) |
| c(HSO3-) |
| c(H2SO3)c(SO32-) |
| c(H+) |
| c(H+) |
| 10-1.2 |
| 10-4.2 |
C.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中,酸性减弱,水的电离被抑制程度减小,水的电离度先增大,故C错误;
D.由图象可知,溶液pH越大,3表示的离子的物质的量分数逐渐增大,则曲线3表示的是SO32-,故D正确;
故选C.
下列叙述正确的是()A.无论是纯水,还是酸性,碱性或中性稀溶液,在常温时,其c(H+)•c(OH- 2020-04-12 …
25℃时水中存在电离平衡:H2O⇌H++OH-,下列关于水的说法,不正确的是()A.水的电离是吸热 2020-04-12 …
100℃时,Kw=1.0×10-12(1)常温下水电离出的离子浓度符合c(H+)•c(OH-)=1 2020-04-12 …
常温下,0.1mol•L-1的HA溶液中c(OH-)/c(H+)=1×10-8,下列叙述中正确的是 2020-05-13 …
常温下,0.1mol·L-1的HA溶液中c(OH-)/c(H+)=1×10-8,下列叙述中正确的是 2020-05-14 …
A B C为常见单质,其中一种为金属,通常情况下A为固体,B为液体,C为气体,D、E、F、G、H、 2020-05-16 …
(5)H的溶液与稀硫酸反应产生的现象为 _____________________。 2020-05-25 …
相关变化率一架巡逻直升机在距地面3km的高度以120km/h的常速沿着一条水平笔直的高速公路向前飞 2020-06-18 …
高等数学导数习题一架巡逻直升机在距地面3km的高度以120km/h的常速沿着一条水平笔直的高速公路 2020-06-18 …
下列溶液肯定呈酸性的是()A.含有H+的溶液B.酚酞显无色的溶液C.c(OH-)<c(H+)的溶液 2020-06-23 …