早教吧作业答案频道 -->化学-->
根据要求完成下列问题:(1)某元素原子共有4个价电子,其中2个价电子位于第三能层d轨道,试回答:该元素核外价电子排布图,基态原子核外电子排布式.该元素的原子序数为,该
题目详情
根据要求完成下列问题:
(1)某元素原子共有4个价电子,其中2个价电子位于第三能层d轨道,试回答:该元素核外价电子排布图___,基态原子核外电子排布式___.该元素的原子序数为___,该元素是___元素(填“金属”或“非金属”).
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:___、___、___.
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.
(4)在下列物质①PCl3②NH3③CCl4④CO2⑤SO2 ⑥BF3⑦SO3⑧H2O中,属于非极性分子的是(填编号)___.
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H3PO4___H3PO3; HClO4___HClO3; H2SO3___H2SO4.
(6)根据价层电子对互斥理论判断下列问题:
①NH3中心原子的杂化方式为___杂化,VSEPR构型为___,分子的立体构型为___.
②BF3分子中,中心原子的杂化方式为___杂化,分子的立体构型为___.
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于___.
(1)某元素原子共有4个价电子,其中2个价电子位于第三能层d轨道,试回答:该元素核外价电子排布图___,基态原子核外电子排布式___.该元素的原子序数为___,该元素是___元素(填“金属”或“非金属”).
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:___、___、___.
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.
(4)在下列物质①PCl3②NH3③CCl4④CO2⑤SO2 ⑥BF3⑦SO3⑧H2O中,属于非极性分子的是(填编号)___.
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H3PO4___H3PO3; HClO4___HClO3; H2SO3___H2SO4.
(6)根据价层电子对互斥理论判断下列问题:
①NH3中心原子的杂化方式为___杂化,VSEPR构型为___,分子的立体构型为___.
②BF3分子中,中心原子的杂化方式为___杂化,分子的立体构型为___.

(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于___.
▼优质解答
答案和解析
(1)某元素原子共有4个价电子,其中2个价电子位于第三能层d轨道,其价电子排布图为: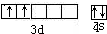 该元素为Ti元素,原子核外有22个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d24s2,该元素位于第四周期第IVB族,为金属元素,
该元素为Ti元素,原子核外有22个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d24s2,该元素位于第四周期第IVB族,为金属元素,
故答案为: ;1s22s22p63s23p63d24s2;22;金属;
;1s22s22p63s23p63d24s2;22;金属;
(2)根据配合物K3[Co(CN)6]结构分析,含有空轨道的金属阳离子为中心离子,所以中心离子为Co3+、有孤对电子的原子或离子为配体,所以配体为CN-、配位数就是配体的个数,所以配位数为6,
故答案为:Co3+;CN-;6;
(3)连接4个不同原子或原子团的碳原子为手性碳原子,所以手性碳原子分别为:
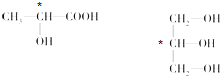 ,故答案为:
,故答案为: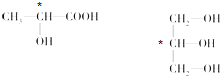 ;
;
(4)①PCl3中P元素化合价为+3,P原子最外层5个电子未全部成键,为极性分子;
②NH3中C元素化合价为-3,N原子最外层5个电子未全部成键,为极性分子;
③CCl4中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;
④CO2中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;
⑤SO2中S元素化合价为+4,S原子最外层6个电子未全部成键,为极性分子;
⑥BF3中B元素化合价为+3,B原子最外层3个电子全部成键,为非极性分子;
⑦SO3中S元素化合价为+6,S原子最外层6个电子全部成键,为非极性分子;
⑧H2O中O元素化合价为-2,O原子最外层6个电子未全部成键,为极性分子;
故选:③④⑥⑦;
(5)同一元素的含氧酸,该元素的化合价越高,对应的含氧酸的酸性越强,故酸性:H3PO4>H3PO3,HClO4>HClO3,H2SO32SO4,
故答案为:>;>;<;
(6)①NH3分子中心N原子孤电子对数=
=1,价层电子对数=3+1=4,故N原子采取sp3杂化,VSEPR构型为正四面体,分子的立体构型为三角锥形,
故答案为:sp3;正四面体;三角锥形;
②BF3分子中,B原子孤电子对数=
=0,价层电子对数=3,故B原子采取sp2杂化,分子的立体构型为平面三角形,
故答案为:sp2;平面三角形;
(7)水分子之间存在氢键,沸点高于同族其它元素氢化物,故答案为:水分子之间存在氢键.
 该元素为Ti元素,原子核外有22个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d24s2,该元素位于第四周期第IVB族,为金属元素,
该元素为Ti元素,原子核外有22个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d24s2,该元素位于第四周期第IVB族,为金属元素,故答案为:
 ;1s22s22p63s23p63d24s2;22;金属;
;1s22s22p63s23p63d24s2;22;金属;(2)根据配合物K3[Co(CN)6]结构分析,含有空轨道的金属阳离子为中心离子,所以中心离子为Co3+、有孤对电子的原子或离子为配体,所以配体为CN-、配位数就是配体的个数,所以配位数为6,
故答案为:Co3+;CN-;6;
(3)连接4个不同原子或原子团的碳原子为手性碳原子,所以手性碳原子分别为:
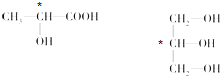 ,故答案为:
,故答案为: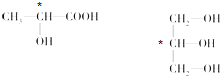 ;
;(4)①PCl3中P元素化合价为+3,P原子最外层5个电子未全部成键,为极性分子;
②NH3中C元素化合价为-3,N原子最外层5个电子未全部成键,为极性分子;
③CCl4中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;
④CO2中C元素化合价为+4,C原子最外层4个电子全部成键,为非极性分子;
⑤SO2中S元素化合价为+4,S原子最外层6个电子未全部成键,为极性分子;
⑥BF3中B元素化合价为+3,B原子最外层3个电子全部成键,为非极性分子;
⑦SO3中S元素化合价为+6,S原子最外层6个电子全部成键,为非极性分子;
⑧H2O中O元素化合价为-2,O原子最外层6个电子未全部成键,为极性分子;
故选:③④⑥⑦;
(5)同一元素的含氧酸,该元素的化合价越高,对应的含氧酸的酸性越强,故酸性:H3PO4>H3PO3,HClO4>HClO3,H2SO3
故答案为:>;>;<;
(6)①NH3分子中心N原子孤电子对数=
| 5-1×3 |
| 2 |
故答案为:sp3;正四面体;三角锥形;
②BF3分子中,B原子孤电子对数=
| 3-1×3 |
| 2 |
故答案为:sp2;平面三角形;
(7)水分子之间存在氢键,沸点高于同族其它元素氢化物,故答案为:水分子之间存在氢键.
看了 根据要求完成下列问题:(1)...的网友还看了以下:
(2009•大连模拟)A、B、C、D是常见的不同主族的短周期元素,它们的原子序数逐渐增大,其中只有 2020-04-08 …
AA、B、C、D、E、F六种短周期元素,原子序数依次增大.A、E同主族,且E元素原子的核外电子数是 2020-04-08 …
下列粒子中,核外电子数最多的是()A硫原子B氯原子C镁原子D氯离子原子变成离子,一定发生改变的是( 2020-05-13 …
下列叙述中,正确的是()A.原子是构成物质的最小粒子B.不同元素原子的核电荷数一定不同C.核外电子 2020-05-20 …
下列元素一定是主族金属元素的是A、原子最外层有2个电子的一种金属元素B、溶点低于100℃的一种金属 2020-05-24 …
实验室用功率P=1500W的紫外灯演示光电效应,紫外线波长入=253nm,阴极离光源距离d=0.5 2020-06-10 …
已知A、B、C、D、E、F均为前四周期元索.A元索的原子价电子排布为ns2np2,B元索的最外层电 2020-07-22 …
下列说法中正确的是()A.某单核粒子的核外电子排布为,则该微粒一定是氖原子B.原子最外层只有1个电 2020-07-29 …
短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素的最高正价是+6价;C元素原子M层 2020-07-29 …
ABCDE为原子序数依次增大的短周期元素,已知ABE3种原子最外层共有10个电子,且这三种元素的最高 2020-10-31 …