早教吧作业答案频道 -->化学-->
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如下框图是从铝土矿中制备铝的工艺流程:已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;②溶液中的硅
题目详情
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如下框图是从铝土矿中制备铝的工艺流程:
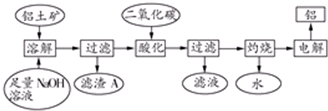
已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学方程式为:2Na2SiO3+2NaAlO2+4H2O═Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)溶解铝土矿时,发生反应的离子方程式为:___.
(2)滤渣A的主要成分___;硅铝酸盐沉淀写成氧化物的形式是___.
(3)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是____
(4)若该工厂用mkg铝土矿共制得n kg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为___.
(5)若将铝溶解,下列试剂中最好选用___(填编号).
A.浓硫酸B. 稀硫酸C.稀HNO3 D.浓HNO3
(6)电解冶炼铝时用Na3AlF6作助熔剂,Na3AlF6是配合物,其中内界是___,配位数为____.

已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学方程式为:2Na2SiO3+2NaAlO2+4H2O═Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)溶解铝土矿时,发生反应的离子方程式为:___.
(2)滤渣A的主要成分___;硅铝酸盐沉淀写成氧化物的形式是___.
(3)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是____
(4)若该工厂用mkg铝土矿共制得n kg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为___.
(5)若将铝溶解,下列试剂中最好选用___(填编号).
A.浓硫酸B. 稀硫酸C.稀HNO3 D.浓HNO3
(6)电解冶炼铝时用Na3AlF6作助熔剂,Na3AlF6是配合物,其中内界是___,配位数为____.
▼优质解答
答案和解析
铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,加入足量的氢氧化钠,氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8沉淀,过滤后得滤渣Fe2O3、Na2Al2Si2O8;滤液用二氧化碳酸化时,将NaAlO2完全转化为Al(OH)3,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;过滤得氢氧化铝沉淀,灼烧得氧化铝,电解氧化铝得单质铝,
(1)Al2O3是两性氢氧化物,SiO2是酸性氧化物,都要与强碱反应生成盐和水,反应的离子方程式为:,
故答案为:2OH-+Al2O3═2AlO2-+H2O、SiO2+2OH-═SiO32-+H2O;
(2)由于氢氧化钠是足量的,所以Al2O3和SiO2充分反应,生成Na2SiO3和NaAlO2,而铝土矿的主要成分是Al2O3,SiO2少量,那么生成的Na2SiO3少,NaAlO2多,
发生反应2Na2SiO3+2NaAlO2+4H2O═Na2Al2Si2O8↓+2H2O+4NaOH后,滤渣有之前不反应的Fe2O3和生成的Na2Al2Si2O8,滤液中有NaOH、余下大量的NaAlO2;
氧化物的形式为:金属氧化物•非金属氧化物•水,注意活泼金属氧化物写在前,则改写成氧化物的形式为:Na2O•Al2O3•2SiO2,
故答案为:Fe2O3;Na2Al2Si2O8、Na2O•Al2O3•2SiO2;
(3)从第2小题的分析可知滤液中的NaAlO2要转化成Al(OH)3不能用盐酸,盐酸是强酸,强酸过量后Al(OH)3会溶解,
故答案为:Al(OH)3溶于强酸而不溶于弱酸,提高Al2O3的提取率;
(4)已知铝nkg,可算出铝的物质的量,n(Al)=
=
mol,根据原子守恒可得:2Al~Al2O3,则三氧化二铝的物质的量:n(Al2O3)=
n(Al),
n(Al2O3)=
mol,所以Al2O3的质量为:m=n(Al2O3)•M(Al2O3)=
mol×102 g•mol-1 =
g,所以Al2O3的质量分数为:
×100%=
%或
%,
故答案为:
%或
%.
(5)因铝与浓硫酸在常温下发生钝化,加热溶解会产生有毒气体SO2,原料利用率低;稀硝酸能溶解铝但会产生NO气体,污染空气,硝酸利用率低;而铝与稀硫酸反应速率较快,产生的H2对空气无污染,则选稀硫酸溶解Al最好,
故答案为:B;
(6)在配合物中,内界是配位单元,含配位键,内界是复杂离子,外界是简单离子;配位原子是提供孤对电子的原子,配位数是配位原子的数目,这里的配位原子是氟原子,有6个,
故答案为:[AlF6]3-;6.
(1)Al2O3是两性氢氧化物,SiO2是酸性氧化物,都要与强碱反应生成盐和水,反应的离子方程式为:,
故答案为:2OH-+Al2O3═2AlO2-+H2O、SiO2+2OH-═SiO32-+H2O;
(2)由于氢氧化钠是足量的,所以Al2O3和SiO2充分反应,生成Na2SiO3和NaAlO2,而铝土矿的主要成分是Al2O3,SiO2少量,那么生成的Na2SiO3少,NaAlO2多,
发生反应2Na2SiO3+2NaAlO2+4H2O═Na2Al2Si2O8↓+2H2O+4NaOH后,滤渣有之前不反应的Fe2O3和生成的Na2Al2Si2O8,滤液中有NaOH、余下大量的NaAlO2;
氧化物的形式为:金属氧化物•非金属氧化物•水,注意活泼金属氧化物写在前,则改写成氧化物的形式为:Na2O•Al2O3•2SiO2,
故答案为:Fe2O3;Na2Al2Si2O8、Na2O•Al2O3•2SiO2;
(3)从第2小题的分析可知滤液中的NaAlO2要转化成Al(OH)3不能用盐酸,盐酸是强酸,强酸过量后Al(OH)3会溶解,
故答案为:Al(OH)3溶于强酸而不溶于弱酸,提高Al2O3的提取率;
(4)已知铝nkg,可算出铝的物质的量,n(Al)=
| 1000ng |
| 27g/mol |
| 1000n |
| 27 |
| 1 |
| 2 |
n(Al2O3)=
| 500n |
| 27 |
| 500n |
| 27 |
| 51000n |
| 27 |
| ||
| 1000mg |
| 5100n |
| 27m |
| 1700n |
| 9m |
故答案为:
| 5100n |
| 27m |
| 1700n |
| 9m |
(5)因铝与浓硫酸在常温下发生钝化,加热溶解会产生有毒气体SO2,原料利用率低;稀硝酸能溶解铝但会产生NO气体,污染空气,硝酸利用率低;而铝与稀硫酸反应速率较快,产生的H2对空气无污染,则选稀硫酸溶解Al最好,
故答案为:B;
(6)在配合物中,内界是配位单元,含配位键,内界是复杂离子,外界是简单离子;配位原子是提供孤对电子的原子,配位数是配位原子的数目,这里的配位原子是氟原子,有6个,
故答案为:[AlF6]3-;6.
看了铝是一种重要的金属,在生产、生...的网友还看了以下:
为什么反正弦函数的主值区间一定在[-∏/2,∏/2],而不是[-∏,∏], 2020-05-22 …
PH=2和PH=4的两种酸混合,混合后溶液PH值一定在2与4之间吗? 2020-05-23 …
有两筐橘子,第一框的个数是第一框的2倍,如果从第一框取出30个放入第二筐,两筐个数相等.原来各多少 2020-05-23 …
有两筐橘子,第一框的个数是第一框的2倍,如果从第一框取出30个放入第二筐,两筐个数相等.原来各多少 2020-05-23 …
试分别写出一个一元二次方程,使它的两根:(1)一根是0,一根是负数;(2)一根是正数,另一根在-2 2020-06-05 …
要使关于x的方程ax2-(a+1)x-4=0的一根在-1和0之间,另一根在2和3之间,试求整数a的 2020-06-12 …
要使关于x的方程ax2-(a+1)x-4=0的一根在-1和0之间,另一根在2和3之间,试求整数a的 2020-06-12 …
第一次在2、3两数之间,写上5.第二次在2、5和5、3之间分别写上7、8.每次都在已写下的两个相邻 2020-06-12 …
第一次在2、3两数之间,写上5.第二次在2、5和5、3之间分别写上7、8.每次都在已写下的两个相邻 2020-06-12 …
将自然数1,2,3,4,5,···按下图排列:(从1到26···)21-22-23-24-25-2 2020-06-30 …