早教吧作业答案频道 -->化学-->
碳和碳的化合物在生产、生活中的应用非常广泛,“低碳生活”已成潮流,清洁能源的开发、煤的综合利用等是实现“低碳生活”的重要途径.试运用所学知识,回答下列问题:(1)甲烷是
题目详情
碳和碳的化合物在生产、生活中的应用非常广泛,“低碳生活”已成潮流,清洁能源的开发、煤的综合利用等是实现“低碳生活”的重要途径.试运用所学知识,回答下列问题:
(1)甲烷是一种重要的清洁燃料
①甲烷燃烧放出大量的热,可直接作为能源用于人类的生产和生活.
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
则表示甲烷燃烧热的热化学方程式___;请从化学反应的本质解释甲烷燃烧放出热量的原因:___.
②在甲烷燃料电池中,甲烷的化学能利用率大大提高.将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,其负极电极反应式是:___.
(2)二甲醚也是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.
①利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)△H=-274kJ/mol
该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是___ (填字母代号).
a.降低温度 b.缩小容器体积 c.加入催化剂
d.增加H2的浓度 e.分离出二甲醚
②二甲醚也可以通过CH3OH分子间脱水制得
2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
已知在280℃,体积不变的密闭容器中进行上述反应,t2时达到平衡,各组分起始和平衡浓度见下表.
①表中c1=___.
在t2min内平均反应速率v(H2O)=___.
②若在400℃,相同的密闭容器中进行上述反应,请在下图中画出CH3OCH3浓度随时间变化的关系图(要求同时画出280℃的,并做好标注).
(1)甲烷是一种重要的清洁燃料
①甲烷燃烧放出大量的热,可直接作为能源用于人类的生产和生活.
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
则表示甲烷燃烧热的热化学方程式___;请从化学反应的本质解释甲烷燃烧放出热量的原因:___.
②在甲烷燃料电池中,甲烷的化学能利用率大大提高.将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,其负极电极反应式是:___.
(2)二甲醚也是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.
①利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)△H=-274kJ/mol
该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是___ (填字母代号).
a.降低温度 b.缩小容器体积 c.加入催化剂
d.增加H2的浓度 e.分离出二甲醚
②二甲醚也可以通过CH3OH分子间脱水制得
2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
已知在280℃,体积不变的密闭容器中进行上述反应,t2时达到平衡,各组分起始和平衡浓度见下表.
| CH3OH(g) | CH3OCH3(g) | H2O(g) | |
| 起始浓度 mol/L | 2.00 | 0.50 | 0 |
| 平衡浓度 mol/L | c1 | 1.00 | c2 |
在t2min内平均反应速率v(H2O)=___.
②若在400℃,相同的密闭容器中进行上述反应,请在下图中画出CH3OCH3浓度随时间变化的关系图(要求同时画出280℃的,并做好标注).

▼优质解答
答案和解析
(1)①已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
根据盖斯定律,(①+②)×
可得:CH4(g)+2O2(g)=CO2(g)+2H2O(l),故热化学方程式为:
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890KJ.mol-1,
化学反应过程中,反应物化学键的破坏需要吸收能量,而生产物化学键的形成要放出能量,当化学键的破坏需要吸收能量小于化学键的形成要放出能量,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890KJ.mol-1;化学反应过程中,反应物化学键的破坏需要吸收能量,而生产物化学键的形成要放出能量,当化学键的破坏需要吸收能量小于化学键的形成要放出能量;
②负极发生氧化反应,甲烷在负极上失去电子,碱性条件下生成碳酸根离子与水,负极电极反应式为:CH4-8e-+10 OH-=CO32-+7H2O,
故答案为:CH4-8e-+10 OH-=CO32-+7H2O;
(2)①a.正反应为放热反应,降低温度平衡逆向移动,二甲醚的产率降低,降低温度反应速率减慢,故a错误;
b.缩小容器体积,压强增大,反应速率加快,平衡向正向移动,二甲醚的产率增大,故b正确;
c.加入催化剂加快反应速率,但不影响平衡移动,二甲醚的产率不变,故c错误;
d.增加H2的浓度,反应速率加快,平衡正向移动,二甲醚的产率增大,故d正确;
e.分离出二甲醚,平衡正向移动,二甲醚的产率增大,但反应速率减慢,故e错误,
故选:bd;
②.①平衡时甲醚浓度变化量为1mol/L-0.5mol/L=0.5mol/L,
2CH3OH(g)⇌CH3OCH3(g)+H2O(g)
起始量(mol/L):2 0.5 0
变化量(mol/L):1 0.5 0.5
平衡量(mol/L):1 1 0.5
则表中c1=1mol/L,在t2min内平均反应速率v(H2O)=
=
mol/(L.min),
故答案为:1;
mol/(L.min);
②升高温度反应速率加快,到达平衡的水解缩短,开始阶段反应速率高于280℃,正反应为放热反应,升高温度平衡逆向移动,平衡时甲醚的浓度小于1mol/L,
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1,温度升高,化学反应速率加快,达到平衡的时间小于t2,平衡逆向移动,达到平衡时,CH3OCH3浓度小于1.00mol/L,CH3OCH3浓度随时问变化的关系图为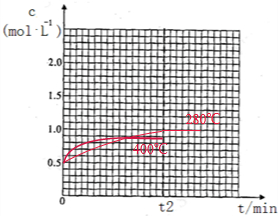 ,
,
故答案为: .
.
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ/mol
根据盖斯定律,(①+②)×
| 1 |
| 2 |
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890KJ.mol-1,
化学反应过程中,反应物化学键的破坏需要吸收能量,而生产物化学键的形成要放出能量,当化学键的破坏需要吸收能量小于化学键的形成要放出能量,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890KJ.mol-1;化学反应过程中,反应物化学键的破坏需要吸收能量,而生产物化学键的形成要放出能量,当化学键的破坏需要吸收能量小于化学键的形成要放出能量;
②负极发生氧化反应,甲烷在负极上失去电子,碱性条件下生成碳酸根离子与水,负极电极反应式为:CH4-8e-+10 OH-=CO32-+7H2O,
故答案为:CH4-8e-+10 OH-=CO32-+7H2O;
(2)①a.正反应为放热反应,降低温度平衡逆向移动,二甲醚的产率降低,降低温度反应速率减慢,故a错误;
b.缩小容器体积,压强增大,反应速率加快,平衡向正向移动,二甲醚的产率增大,故b正确;
c.加入催化剂加快反应速率,但不影响平衡移动,二甲醚的产率不变,故c错误;
d.增加H2的浓度,反应速率加快,平衡正向移动,二甲醚的产率增大,故d正确;
e.分离出二甲醚,平衡正向移动,二甲醚的产率增大,但反应速率减慢,故e错误,
故选:bd;
②.①平衡时甲醚浓度变化量为1mol/L-0.5mol/L=0.5mol/L,
2CH3OH(g)⇌CH3OCH3(g)+H2O(g)
起始量(mol/L):2 0.5 0
变化量(mol/L):1 0.5 0.5
平衡量(mol/L):1 1 0.5
则表中c1=1mol/L,在t2min内平均反应速率v(H2O)=
| 0.5mol/L |
| t2min |
| 1 |
| 2t2 |
故答案为:1;
| 1 |
| 2t2 |
②升高温度反应速率加快,到达平衡的水解缩短,开始阶段反应速率高于280℃,正反应为放热反应,升高温度平衡逆向移动,平衡时甲醚的浓度小于1mol/L,
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1,温度升高,化学反应速率加快,达到平衡的时间小于t2,平衡逆向移动,达到平衡时,CH3OCH3浓度小于1.00mol/L,CH3OCH3浓度随时问变化的关系图为
 ,
,故答案为:
 .
.
看了碳和碳的化合物在生产、生活中的...的网友还看了以下:
用思考用头脑要我们融会贯通知识才能灵活运用所学到的组成1个句子用思考用头脑要我们融会贯通知识才能灵 2020-04-27 …
问3道题!不是奥数,初一的知识!1.X为何值时,代数式5- x+2/3的值与代数式7-X的值相等. 2020-05-13 …
用方程解,六年级下的知识.1.一台织布机4小时织布24米,照这样的速度,9小时可以织布多少米 2. 2020-05-16 …
解读以下四句话,并谈谈你的认识1为天地立心2为生命立命3为往圣继绝学4为天下开太平 2020-05-21 …
写出同义句,填空就行,每空一词,请尽量用初中学生学过的知识.1.Youcantakeataxiar 2020-05-21 …
乌篷摇梦到春江的习题及答案18.请分别用一句话概括作者在富春江的所想.1.我始想;2我还想;3我在 2020-06-04 …
《大学英语1》2010年春学期在线作业(二)——考查内容为第3课、第4课、第5课的知识1.Heis 2020-06-06 …
有牵扯到高中的知识1.潜水艇下沉时,向水底发射出持续时间为△t1的某脉冲声波信号,经过一段时间,该 2020-06-07 …
能帮忙分析一下这几句英语吗?本人自学的,所以~1:Iwasinchargeoutsidewhere 2020-06-10 …
1.小明和爷爷在湖中叉鱼,请根据此场景,写出2个现象及相关的物理知识:示例现象:小明看到水中的鱼; 2020-06-10 …