早教吧作业答案频道 -->化学-->
在学习盐的化学性质时,老师将一定量的碳酸钠溶液与氯化钙溶液混合,过滤反应后的混合物,老师要求同学们探究滤液中溶质的组成.回答有关问题:查阅资料碳酸钠溶液显碱性,氯
题目详情
在学习盐的化学性质时,老师将一定量的碳酸钠溶液与氯化钙溶液混合,过滤反应后的混合物,老师要求同学们探究滤液中溶质的组成.回答有关问题:
【查阅资料】碳酸钠溶液显碱性,氯化钠、氯化钙溶液均显中性.
【提出猜想】猜想1:滤液中溶质是NaCl; 猜想2:滤液中溶质是NaCl和___(填化学式)的混合物;猜想3:滤液中溶质是NaCl和Na2CO3的混合物.
【实验探究】(1)取少量滤液于试管中,滴加2~3滴无色酚酞试液,振荡,无明显现象.同学们认为猜想___不成立.
(2)另取少量滤液于另一支试管中,滴加碳酸钠溶液,若有___(填实验现象)证明猜想2成立.
【问题讨论】(1)甲同学认为要证明猜想2成立也可以改用硫酸钠溶液.你认为甲同学___(填“能”或“不能”)达到实验目的.
(2)乙同学认为要证明猜想2成立也可以改用硝酸银溶液.你认为乙同学___(填“能”或“不能”)达到实验目的.理由是___.
【探索拓展】现有一份由碳酸钠和氯化钠组成的混合物.某兴趣小组的同学为确定其组成,他们取了5g该混合物的样品,在烧杯中配制成60g溶液,再向其中逐滴加入10%的氯化钙溶液,测得加入氯化钙溶液的质量与产生沉淀的质量关系如图所示.
计算:
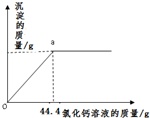
(1)样品中碳酸钠的质量分数.(精确到0.1%)
(2)a点所示溶液中溶质的质量分数.(精确到0.1%)
【查阅资料】碳酸钠溶液显碱性,氯化钠、氯化钙溶液均显中性.
【提出猜想】猜想1:滤液中溶质是NaCl; 猜想2:滤液中溶质是NaCl和___(填化学式)的混合物;猜想3:滤液中溶质是NaCl和Na2CO3的混合物.
【实验探究】(1)取少量滤液于试管中,滴加2~3滴无色酚酞试液,振荡,无明显现象.同学们认为猜想___不成立.
(2)另取少量滤液于另一支试管中,滴加碳酸钠溶液,若有___(填实验现象)证明猜想2成立.
【问题讨论】(1)甲同学认为要证明猜想2成立也可以改用硫酸钠溶液.你认为甲同学___(填“能”或“不能”)达到实验目的.
(2)乙同学认为要证明猜想2成立也可以改用硝酸银溶液.你认为乙同学___(填“能”或“不能”)达到实验目的.理由是___.
【探索拓展】现有一份由碳酸钠和氯化钠组成的混合物.某兴趣小组的同学为确定其组成,他们取了5g该混合物的样品,在烧杯中配制成60g溶液,再向其中逐滴加入10%的氯化钙溶液,测得加入氯化钙溶液的质量与产生沉淀的质量关系如图所示.
计算:

(1)样品中碳酸钠的质量分数.(精确到0.1%)
(2)a点所示溶液中溶质的质量分数.(精确到0.1%)
▼优质解答
答案和解析
【提出猜想】碳酸钠溶液与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,在反应过程中,如果二者恰好完全反应,则滤液中的溶质只有NaCl;若Na2CO3有剩余,则溶液中的溶质除了NaCl还有Na2CO3;若CaCl2有剩余,则溶液中的溶质除了NaCl还有CaCl2;
【实验探究】
(1)由【查阅资料】可知:碳酸钠溶液显碱性,氯化钠、氯化钙溶液显中性,酚酞是一种酸碱指示剂,遇碱变红,遇酸不变色,由于“取少量滤液于试管中,滴加2~3滴无色酚酞试液,振荡,无明显现象”说明滤液里面没有碱性的物质,由题意可知:溶液中没有显碱性的碳酸钠;同学们认为猜想3不成立;
(2)由于结论是猜想2成立,也就是证明滤液中溶质有:NaCl还有CaCl2,加入Na2CO3溶液后,碳酸钠溶液与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,反应的化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl;可观察到有白色沉淀生成;
【问题讨论】(1)证明滤液中溶质有:NaCl还有CaCl2,加入Na2SO4溶液后,硫酸钠溶液与氯化钙溶液反应生成硫酸钙和氯化;由于硫酸钙微溶,可观察到有白色沉淀(CaSO4)生成;所以甲同学能达到实验目的;
(2)证明滤液中溶质有:NaCl还有CaCl2,加入AgNO3溶液后,NaCl和CaCl2都能和AgNO3反应生成沉淀.NaCl和AgNO3反应生成氯化银和硝酸钠,化学方程式为:NaCl+AgNO3═AgCl↓+NaNO3;CaCl2和AgNO3反应生成氯化银和硝酸钙,化学方程式为:CaCl2+2AgNO3═2AgCl↓+Ca(NO3)2;无法证明溶液中含有CaCl2;所以乙同学不能达到实验目的,理由是:氯化钠和硝酸银反应也能够生成白色沉淀.
【探索拓展】 设该纯碱样品中碳酸钠的质量为x,生成氯化钠的质量为y,生成沉淀的质量为z,
参加反应的氯化钙的质量为:44.4g×10%=4.44g,则
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 111 100 117
x 4.44g z y
=
=
=
x=4.24g,z=4g,y=4.68g;
该纯碱样品中碳酸钠的质量分数为:
×100%=84.8%;
反应后不饱和溶液中溶质的质量为:5g-4.24g+4.68g=5.44g,反应后总溶液质量为:60g+44.4g-4g=100.4g,恰好完全反应时,
所得不饱和溶液中溶质的质量分数为:
×100%=5.4%.
故答案为:[提出猜想]CaCl2
[实验探究](1)3 (2)白色沉淀产生
[问题讨论](1)能 (2)不能 因为猜想1和猜想3都会生成白色沉淀
[探索扩展](1)84.8% (2)5.4%
【实验探究】
(1)由【查阅资料】可知:碳酸钠溶液显碱性,氯化钠、氯化钙溶液显中性,酚酞是一种酸碱指示剂,遇碱变红,遇酸不变色,由于“取少量滤液于试管中,滴加2~3滴无色酚酞试液,振荡,无明显现象”说明滤液里面没有碱性的物质,由题意可知:溶液中没有显碱性的碳酸钠;同学们认为猜想3不成立;
(2)由于结论是猜想2成立,也就是证明滤液中溶质有:NaCl还有CaCl2,加入Na2CO3溶液后,碳酸钠溶液与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,反应的化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl;可观察到有白色沉淀生成;
【问题讨论】(1)证明滤液中溶质有:NaCl还有CaCl2,加入Na2SO4溶液后,硫酸钠溶液与氯化钙溶液反应生成硫酸钙和氯化;由于硫酸钙微溶,可观察到有白色沉淀(CaSO4)生成;所以甲同学能达到实验目的;
(2)证明滤液中溶质有:NaCl还有CaCl2,加入AgNO3溶液后,NaCl和CaCl2都能和AgNO3反应生成沉淀.NaCl和AgNO3反应生成氯化银和硝酸钠,化学方程式为:NaCl+AgNO3═AgCl↓+NaNO3;CaCl2和AgNO3反应生成氯化银和硝酸钙,化学方程式为:CaCl2+2AgNO3═2AgCl↓+Ca(NO3)2;无法证明溶液中含有CaCl2;所以乙同学不能达到实验目的,理由是:氯化钠和硝酸银反应也能够生成白色沉淀.
【探索拓展】 设该纯碱样品中碳酸钠的质量为x,生成氯化钠的质量为y,生成沉淀的质量为z,
参加反应的氯化钙的质量为:44.4g×10%=4.44g,则
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 111 100 117
x 4.44g z y
| 106 |
| x |
| 111 |
| 4.44g |
| 100 |
| z |
| 117 |
| y |
x=4.24g,z=4g,y=4.68g;
该纯碱样品中碳酸钠的质量分数为:
| 4.24g |
| 5g |
反应后不饱和溶液中溶质的质量为:5g-4.24g+4.68g=5.44g,反应后总溶液质量为:60g+44.4g-4g=100.4g,恰好完全反应时,
所得不饱和溶液中溶质的质量分数为:
| 5.44g |
| 100.4g |
故答案为:[提出猜想]CaCl2
[实验探究](1)3 (2)白色沉淀产生
[问题讨论](1)能 (2)不能 因为猜想1和猜想3都会生成白色沉淀
[探索扩展](1)84.8% (2)5.4%
看了在学习盐的化学性质时,老师将一...的网友还看了以下:
市售过碳酸钠(Na2CO4)中往往含有少量杂质碳酸钠,化学兴趣小组同学购得一包市售过碳酸钠样品,欲 2020-04-08 …
下列有关物质的分类方法采用的是交叉分类法的是()A.物质可分为纯净物和混合物B.碳酸钠既是钠盐也是 2020-05-02 …
有一瓶因保存不当而部分变质的氢氧化钠固体,为测定其成分,称取10g样品配成溶液,向其中滴加溶质质量 2020-07-12 …
下列有关物质和结构的说法不合理的是()A.组成生物大分子的每一个单体都是以若干个相连的碳原子构成的 2020-07-20 …
在常温时,单质碳的化学性质(填“稳定”或“不稳定”),在点燃或高温时,具有性和性,单质碳在氧气中燃烧 2020-12-09 …
下列有关物质用途的说法不正确的是()A.食盐是最好的调味品,如果没有盐,许多菜肴将会淡而无味B.碳酸 2020-12-14 …
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物 2020-12-28 …
关于俯视仰视溶质质量分数偏大偏小的问题俯视,量筒中水的体积比实际值偏高,所以m=pv可得质量也比实际 2021-01-02 …
下列有关“物质--性质--用途”的叙述中,用途与性质不相关的是()序号物质性质用途①一氧化碳还原性冶 2021-01-14 …
将碳酸钠和碳酸氢钠混合物27.4g加热到质量不再变化时剩余物质质量21.2g.再另取式样27.4g加 2021-02-09 …