早教吧作业答案频道 -->化学-->
铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:(1)下列四种化合物中含铜量最高的是(填字母)A.Cu5FeS4B.CuFeS2C.Cu2SD.Cu2(OH)2CO3(2)2
题目详情
铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:
(1)下列四种化合物中含铜量最高的是___(填字母)
A.Cu5FeS4 B.CuFeS2 C.Cu2S D.Cu2(OH)2CO3
(2)2014年我国精炼铜产量796万吨,若全部由含Cu2S质量分数为32%的铜矿石冶炼得到,则需要铜矿石质量为___万吨.(保留一位小数)
(3)可溶性铜盐常用于生产其它含铜化合物.在KOH溶液中加入一定量的CuSO4溶液,再加入一定量的还原剂--肼(N2H4),加热并保持温度在90℃,生成一种对环境无污染的气体,反应完全后,分离,洗涤,真空干燥得到纳米氧化亚铜固体(Cu2O).
①该制备过程的反应方程式为___.
②工业上常用的固液分离设备有___(填字母)
A.离心机 B.分馏塔 C.框式压滤机 D.反应釜
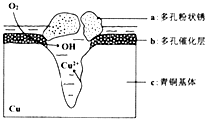
(4)我国出土的青铜器工艺精湛,具有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀.如图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图:
①腐蚀过程中,负极是___(填“a”“b”或“c”),正极反应方程式为___.
②环境中的Cl-扩散到孔口,并与正极产物和负极产物生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为___.

(1)下列四种化合物中含铜量最高的是___(填字母)
A.Cu5FeS4 B.CuFeS2 C.Cu2S D.Cu2(OH)2CO3
(2)2014年我国精炼铜产量796万吨,若全部由含Cu2S质量分数为32%的铜矿石冶炼得到,则需要铜矿石质量为___万吨.(保留一位小数)
(3)可溶性铜盐常用于生产其它含铜化合物.在KOH溶液中加入一定量的CuSO4溶液,再加入一定量的还原剂--肼(N2H4),加热并保持温度在90℃,生成一种对环境无污染的气体,反应完全后,分离,洗涤,真空干燥得到纳米氧化亚铜固体(Cu2O).
①该制备过程的反应方程式为___.
②工业上常用的固液分离设备有___(填字母)
A.离心机 B.分馏塔 C.框式压滤机 D.反应釜
(4)我国出土的青铜器工艺精湛,具有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀.如图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图:
①腐蚀过程中,负极是___(填“a”“b”或“c”),正极反应方程式为___.
②环境中的Cl-扩散到孔口,并与正极产物和负极产物生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为___.
▼优质解答
答案和解析
(1)A.Cu5FeS4中含铜量为
=0.63;
B.CuFeS2中含铜量为
=0.35;
C.铜量为
=0.8;
D.Cu2(OH)2CO3中含铜量为
=0.58,
故答案为:C;
(2)Cu2S中铜元素的质量分数=
×100%=80%;则X吨含Cu2S 32%的铜矿石中含铜元素质量=Xt×80%×32%=796万t,解得X=3109.4万吨,
故答案为:3109.4;
(3)①由题意可知碱性条件下硫酸铜和N2H4发生氧化还原反应,反应的化学方程式为4CuSO4+N2H4+8KOH
2Cu2O+N2↑+4K2SO4+6H2O,
故答案为:4CuSO4+N2H4+8KOH
2Cu2O+N2↑+4K2SO4+6H2O;
②工业上常用的固液分离设备有离心机和框式压滤机,故答案为:AC;
(4)①根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极,即c是负极,正极发生还原反应,电极方程式为O2+2H2O+4e-═4OH-,
故答案为:c;O2+2H2O+4e-═4OH-;
②Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀,离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓,
故答案为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓.
| 320 |
| 504 |
B.CuFeS2中含铜量为
| 64 |
| 184 |
C.铜量为
| 128 |
| 160 |
D.Cu2(OH)2CO3中含铜量为
| 128 |
| 221 |
故答案为:C;
(2)Cu2S中铜元素的质量分数=
| 64×2 |
| 160 |
故答案为:3109.4;
(3)①由题意可知碱性条件下硫酸铜和N2H4发生氧化还原反应,反应的化学方程式为4CuSO4+N2H4+8KOH
| ||
故答案为:4CuSO4+N2H4+8KOH
| ||
②工业上常用的固液分离设备有离心机和框式压滤机,故答案为:AC;
(4)①根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极,即c是负极,正极发生还原反应,电极方程式为O2+2H2O+4e-═4OH-,
故答案为:c;O2+2H2O+4e-═4OH-;
②Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀,离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓,
故答案为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓.
看了 铜是一种重要的有色金属,近年...的网友还看了以下:
九年级英语第一单元by+ving的句子只要两句就行还有一般现在时问答句aloud副词选句三单主+s 2020-05-02 …
Wastherea……?Werethere……s?问答各8句 2020-05-13 …
问答/已知求解答甲、乙两列火车,甲车的速度是15m/s,乙车的速度是11m/s,甲车长120m.如 2020-05-14 …
●试题二 对文法G[S]:S→a|∧|(T);T→T,S|S;回答问题1~问题3。 【问题1】 对文 2020-05-26 …
1质量相等的SO2和SO3(1)所含S元素的质量比(2)S原子的个数比2在FeOFe2O3Fe3O 2020-06-06 …
已知非空集合S真包含于{1,2,3,4,5,6},若a∈S,则必有7-a∈S.问这样的集合有几个? 2020-08-01 …
关于凸包的问题在数理经济学课本中,定义集合S的凸包为包含S的凸集的交,并说由此可以看出凸包具有如下 2020-08-02 …
高一数学集合的问题1、如果x∈S则2-x∈S的自然数x构成集合S,若S只有两个元素,则S=?(答案是 2020-11-30 …
细胞内的有机物的化学元素细胞内含N的小分子物质有什么?含N的大分子物质有什么?含P的小分子物质有什么 2020-12-02 …
现有含盐4%的盐水186千克,如果将盐水配制成含盐池7%的盐水,应加盐多少千克?请问:1现有含盐4% 2020-12-19 …