早教吧作业答案频道 -->化学-->
导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中.利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研
题目详情
导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中.利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一.
(1)反应2SO2(g)+O2(g)⇌2SO3(g)是硫酸工业中的重要反应;提高SO2的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO2的转化率:下列可采用的措施是___
A.加入V2O5作催化剂,.B.通过量空气C.高温D.增大压强
(2)一定条件下,向2L密闭容器中通入2molSO2(g)、1molO2(g)和0.2SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=___;用O2的浓度变化表示从O-2min内该反应的平均速率v=___;恒温下,若向容器中再加入2molSO2(g),则重新达到平衡时SO2的总转化率___50%(填“>”、“<”、“=”)
(3)能说明该反应已经达到平衡状态的是___
A.v(SO2)=2v(O2)
B.容器内压强保持不变.
B.v逆(SO3)=v正(SO2)
D.容器内物质的密度保持不变.
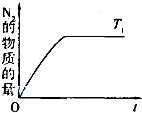
(4)在催化剂作用下用CH4将氮氧化物还原为N2可以消除氮氧化物带来的污染,请写出CH4与NO反应的化学方程式:___;温度为T1时在密闭容器中研究CH4催化还原氮氧化物的反应,反应过程中产物N2的物质的量随时间的变化曲线如图所示,请在图中补画出温度为T2(T2>T1)时,n(N2)的变化曲线(已知该反应是放热反应).

(1)反应2SO2(g)+O2(g)⇌2SO3(g)是硫酸工业中的重要反应;提高SO2的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO2的转化率:下列可采用的措施是___
A.加入V2O5作催化剂,.B.通过量空气C.高温D.增大压强
(2)一定条件下,向2L密闭容器中通入2molSO2(g)、1molO2(g)和0.2SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=___;用O2的浓度变化表示从O-2min内该反应的平均速率v=___;恒温下,若向容器中再加入2molSO2(g),则重新达到平衡时SO2的总转化率___50%(填“>”、“<”、“=”)
(3)能说明该反应已经达到平衡状态的是___
A.v(SO2)=2v(O2)
B.容器内压强保持不变.
B.v逆(SO3)=v正(SO2)
D.容器内物质的密度保持不变.
(4)在催化剂作用下用CH4将氮氧化物还原为N2可以消除氮氧化物带来的污染,请写出CH4与NO反应的化学方程式:___;温度为T1时在密闭容器中研究CH4催化还原氮氧化物的反应,反应过程中产物N2的物质的量随时间的变化曲线如图所示,请在图中补画出温度为T2(T2>T1)时,n(N2)的变化曲线(已知该反应是放热反应).
▼优质解答
答案和解析
(1)A、加入催化剂,催化剂不影响化学平衡,二氧化硫的转化率不变,故错误;
B、通入过量的空气,平衡向着正向移动,二氧化硫的转化率增大,故正确;
C、升高温度,平衡向着逆向移动,二氧化硫的转化率减小,故错误;
D、增大压强,增大压强,平衡向着正向移动,二氧化硫的转化率增大,故正确;
故选:BD;
(2)一定条件下,2SO2(g)+O2(g)⇌2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,列出化学平衡的三段式计算:
2SO2(g)+O2(g)⇌2SO3(g)
起始量(mol/L) 1 0.5 0.1
变化量(mol/L) 0.5 0.25 0.5
平衡量(mol/L) 0.5 0.25 0.6
平衡常数K=
=5.76;
用O2的浓度变化表示从O-2min内该反应的平均速率v=
=0.125mol/(L•min)
若往容器中再加入2mol SO2(g),平衡正向进行,由于三氧化硫浓度比起始大,则重新达到平衡时SO2的总转化率小于50%,
故答案为:5.76;0.125mol/(L•min);<;
(3)A.v(SO2)=2v(O2),只要反应发生,速率之比就符合这样的关系,故错误;
B.容器内压强保持不变,说明达平衡状态,故正确.
C.v逆(SO3)=v正(SO2),正逆反应速率相等,故正确;
D.容器内物质的密度始终保持不变,故错误;
故选:BC;
(4)CH4与NO反应的化学方程式为CH4+4NO═2N2+CO2+2H2O;升高温度平衡逆向移动,N2的物质的量减小,达平衡的时间缩短,所以图形为: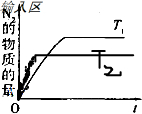 ,故答案为:CH4+4NO═2N2+CO2+2H2O;
,故答案为:CH4+4NO═2N2+CO2+2H2O; ;
;
B、通入过量的空气,平衡向着正向移动,二氧化硫的转化率增大,故正确;
C、升高温度,平衡向着逆向移动,二氧化硫的转化率减小,故错误;
D、增大压强,增大压强,平衡向着正向移动,二氧化硫的转化率增大,故正确;
故选:BD;
(2)一定条件下,2SO2(g)+O2(g)⇌2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,列出化学平衡的三段式计算:
2SO2(g)+O2(g)⇌2SO3(g)
起始量(mol/L) 1 0.5 0.1
变化量(mol/L) 0.5 0.25 0.5
平衡量(mol/L) 0.5 0.25 0.6
平衡常数K=
| 0.62 |
| 0.52×0.25 |
用O2的浓度变化表示从O-2min内该反应的平均速率v=
| 0.25 |
| 2 |
若往容器中再加入2mol SO2(g),平衡正向进行,由于三氧化硫浓度比起始大,则重新达到平衡时SO2的总转化率小于50%,
故答案为:5.76;0.125mol/(L•min);<;
(3)A.v(SO2)=2v(O2),只要反应发生,速率之比就符合这样的关系,故错误;
B.容器内压强保持不变,说明达平衡状态,故正确.
C.v逆(SO3)=v正(SO2),正逆反应速率相等,故正确;
D.容器内物质的密度始终保持不变,故错误;
故选:BC;
(4)CH4与NO反应的化学方程式为CH4+4NO═2N2+CO2+2H2O;升高温度平衡逆向移动,N2的物质的量减小,达平衡的时间缩短,所以图形为:
 ,故答案为:CH4+4NO═2N2+CO2+2H2O;
,故答案为:CH4+4NO═2N2+CO2+2H2O; ;
;
看了导致空气污染的主要原因来自于化...的网友还看了以下:
计算下列各题,要写出主要计算过程,能用简便方法的要用简便方法计算.①16×18-120÷15②3. 2020-04-07 …
sat对于语法的要求是什么程度/我现在高二,英语110120左右,满分150,语法不好,所以成绩不 2020-04-26 …
脱式计算(能用简便方法的要用简便方法计算).要做出来,谢谢了哟,急!8分之3÷4分之1+6×4分之 2020-05-13 …
现在全世界都在地震,看来2012是真的要来了都来发表下看法吧! 2020-05-17 …
法的基本成份或基本元素称之为().A.法律关系B.法的要素C.法的渊源D.法的效力满分:2分法的基 2020-05-23 …
下列选项中,不属于法的要素的是()。A.法律概念B.法律事实C.法律规则D.法律原则 2020-06-04 …
法的要素包括()。A.法律概念B.法律原则C.法律制度D.法律规则 2020-06-04 …
六年级小学生最常用的修辞方法有哪些?(人教版的)注意,是修辞手法,什么举例子、打比方是说明方法,不 2020-06-27 …
吟唱魔法咒语用哪种语言?相信魔法的人来看,吟唱魔法的时候要用哪种语言?中文行不?如果是别的语言,那 2020-07-03 …
书法的由来(书法有哪些种类,它们是怎么来的有什么特点),要从中国的甲骨文开始 2020-07-11 …