早教吧作业答案频道 -->化学-->
实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备硫代硫酸钠.反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于
题目详情
实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备硫代硫酸钠.反应原理为:
2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水.按图1所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热.待烧瓶中固体不再减少时,停止加热.将烧瓶取下,立即趁热过滤,再冷却结晶,过滤.将所得固体洗涤、干燥,得到Na2S•9H2O晶体.
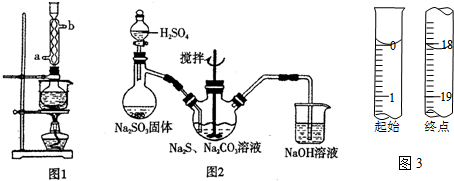
(1)在提纯过程中“趁热过滤”操作的目的是___;
(2)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是___,NaOH溶液的作用是___.
(3)保险粉样品中Na2S2O3•5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6.准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂.用0.1000 mol•L¯1碘的标准溶液进行滴定.
请回答:
①到达滴定终点的标志___;
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为___mL,产品的纯度为___(设Na2S2O3•5H2O相对分子质量为M).
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的纯度的测量结果___(填“偏高”、“偏低”或“不变”).
2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水.按图1所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热.待烧瓶中固体不再减少时,停止加热.将烧瓶取下,立即趁热过滤,再冷却结晶,过滤.将所得固体洗涤、干燥,得到Na2S•9H2O晶体.

(1)在提纯过程中“趁热过滤”操作的目的是___;
(2)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是___,NaOH溶液的作用是___.
(3)保险粉样品中Na2S2O3•5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6.准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂.用0.1000 mol•L¯1碘的标准溶液进行滴定.
请回答:
①到达滴定终点的标志___;
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为___mL,产品的纯度为___(设Na2S2O3•5H2O相对分子质量为M).
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的纯度的测量结果___(填“偏高”、“偏低”或“不变”).
▼优质解答
答案和解析
(1)过滤除去不溶杂质,若温度冷却,硫化钠会结晶析出而损失,故答案为:防止硫化钠结晶析出而损失、去除杂质;(2)盛放Na2SO3固体的玻璃仪器是蒸馏烧瓶,三颈烧瓶内反应结束会有未反应的二氧化硫,装置中氢氧化钠...
看了实验室用SO2通入Na2S和N...的网友还看了以下:
尿是在肾脏中生成的,生成的机制很复杂.1924年美国生理学家A.N.Richards等人用直径10 2020-04-06 …
用化学符号表示下列微粒.(1)2个氟离子:.(2)n个汞原子:.(3)3个三氧化硫分子:.(4)+ 2020-05-14 …
在微粒结构示意图中,若n为不同数值可表示核外电子排布相同的不同微粒.(1)当n=10时,该图表示的 2020-05-14 …
(1)已知x>-1,n∈N*,求证:(1+x)n≥1+nx(2)已知m>0,n∈N*,ex≥m+n 2020-05-17 …
如图所示,有一根均匀铁棒,长为L,OA=L4,重力G=600N,为了不使这根铁棒的B端下沉,所需外 2020-05-23 …
一艘宇宙飞船的横截面积为S米2,以恒定速度v米/秒匀速航行.设在宇宙空间中每立方米有n颗微流星,那 2020-06-05 …
如图甲,将一根粗细均匀的木棒放在水平地面上,稍微抬起一端至少用力100N,则木棒的重力约是N.图乙 2020-07-06 …
三聚氰胺(化学式为C3H6N6)是一种化工原料,有轻微毒性,计算:(1)三聚氰胺分子中的C.H.N. 2020-12-12 …
金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,该物质的中心原子价电子数与配体提供电 2020-12-12 …
北京时间2013年4月20日8时2分在四川省雅安市芦山县(30.3°N,103.0°E)发生7.0级 2020-12-18 …