早教吧作业答案频道 -->化学-->
研究发现,NOx和SO2是雾霾的主要成分.Ⅰ.NOx主要来源于汽车尾气.已知:N2(g)+O2(g)⇌2NO(g)△H=+180.50kJ•mol-12CO(g)+O2(g)⇌2CO2(g)△H=-566.00kJ•mol-1(1)为了减轻大气污染,人
题目详情
研究发现,NOx和SO2是雾霾的主要成分.
Ⅰ.NOx主要来源于汽车尾气.
已知:N2(g)+O2(g)⇌2NO(g)△H=+180.50 kJ•mol-1
2CO(g)+O2(g)⇌2 CO2(g)△H=-566.00kJ•mol-1
(1)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环.写出该反应的热化学方程式___.
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0-15min)中NO的物质的量随时间变化的关系如图1所示.
①T℃时该化学反应的平衡常数K=___;平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将___移动.(填“向左”、“向右”或“不)
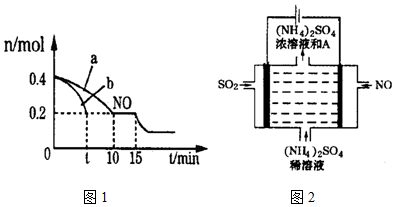
②图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是___(填“a”或“b”).
③15min时,若改变外界反应条件,导致n(NO)发生如图2所示的变化,则改变的条件可能是___.
Ⅱ.SO2主要来源于煤的燃烧.燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键.
(3)用纯碱溶液吸收SO2可将其转化为HSO3-.该反应的离子方程式是___.
(4)如图2电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-.物质A的化学式为___,阴极的电极反应式是___.
Ⅰ.NOx主要来源于汽车尾气.
已知:N2(g)+O2(g)⇌2NO(g)△H=+180.50 kJ•mol-1
2CO(g)+O2(g)⇌2 CO2(g)△H=-566.00kJ•mol-1
(1)为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环.写出该反应的热化学方程式___.
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0-15min)中NO的物质的量随时间变化的关系如图1所示.
①T℃时该化学反应的平衡常数K=___;平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将___移动.(填“向左”、“向右”或“不)

②图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是___(填“a”或“b”).
③15min时,若改变外界反应条件,导致n(NO)发生如图2所示的变化,则改变的条件可能是___.
Ⅱ.SO2主要来源于煤的燃烧.燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键.
(3)用纯碱溶液吸收SO2可将其转化为HSO3-.该反应的离子方程式是___.
(4)如图2电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-.物质A的化学式为___,阴极的电极反应式是___.
▼优质解答
答案和解析
(1)已知:N2(g)+O2(g)⇌2NO(g)△H=+180.50kJ•mol-1①
2CO(g)+O2(g)⇌CO2(g)△H=-566.00kJ•mol-1②
根据盖斯定律:②-①得到:2NO(g)+2CO(g)=2CO2(g)+N2(g)△H=-746.50 kJ•mol-1;
故答案为:2NO(g)+2CO(g)=2CO2(g)+N2(g)△H=-746.50 kJ•mol-1;
(2)①起始时,NO为0.4mol,平衡时NO为0.2mol,
2NO(g)+2CO(g)
2CO2(g)+N2
起始物质的量:0.4mol 0.4mol 0 0
转化的物质量:0.2mol 0.2mol 0.2mol 0.1mol
平衡物质的量:0.2mol 0.2mol 0.2mol 0.1mol
则平衡时的浓度:c(NO)=0.1mol/L,c(CO)=0.1mol/L,c(CO2)=0.1mol/L,c(N2)=0.05mol/L,
K=
=
=5(mol/L)-1;
平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,则c(CO)=0.5mol/L,c(N2)=0.45mol/L,
Qc=
=
=1.8<k,则平衡将向右移动;
故答案为:5(mol/L)-1;向右;
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;
故答案为:b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;
故答案为:增加CO的物质的量浓度或增大压强;
(3)碳酸钠溶液与SO2反应生成亚硫酸氢钠和二氧化碳,其反应的离子方程式为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
故答案为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
(4)电解装罝可将雾霾中的NO、SO2分别转化为NH4+和SO42-,则电解方程式为5SO2+2NO+8H2O
(NH4)2SO4+4H2SO4,由电解方程式可知,物质A为硫酸,其的化学式H2SO4; 电解时,阳极上二氧化硫失电子生成硫酸根离子,则阳极的电极反应式是SO2+2H2O-2 e-═SO42-+4H+;阴极是一氧化氮发生还原反应生成铵根离子,电极反应式为:NO+6H++5e-=NH4++H2O;
故答案为:H2SO4;NO+6H++5e-=NH4++H2O.
2CO(g)+O2(g)⇌CO2(g)△H=-566.00kJ•mol-1②
根据盖斯定律:②-①得到:2NO(g)+2CO(g)=2CO2(g)+N2(g)△H=-746.50 kJ•mol-1;
故答案为:2NO(g)+2CO(g)=2CO2(g)+N2(g)△H=-746.50 kJ•mol-1;
(2)①起始时,NO为0.4mol,平衡时NO为0.2mol,
2NO(g)+2CO(g)
| ||
起始物质的量:0.4mol 0.4mol 0 0
转化的物质量:0.2mol 0.2mol 0.2mol 0.1mol
平衡物质的量:0.2mol 0.2mol 0.2mol 0.1mol
则平衡时的浓度:c(NO)=0.1mol/L,c(CO)=0.1mol/L,c(CO2)=0.1mol/L,c(N2)=0.05mol/L,
K=
| c2(CO2)×c(N2) |
| c2(NO)×c2(CO) |
| 0.12×0.05 |
| 0.12×0.12 |
平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,则c(CO)=0.5mol/L,c(N2)=0.45mol/L,
Qc=
| c2(CO2)×c(N2) |
| c2(NO)×c2(CO) |
| 0.12×0.45 |
| 0.12×0.52 |
故答案为:5(mol/L)-1;向右;
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;
故答案为:b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;
故答案为:增加CO的物质的量浓度或增大压强;
(3)碳酸钠溶液与SO2反应生成亚硫酸氢钠和二氧化碳,其反应的离子方程式为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
故答案为:H2O+2SO2+CO32-═2HSO3-+CO2↑;
(4)电解装罝可将雾霾中的NO、SO2分别转化为NH4+和SO42-,则电解方程式为5SO2+2NO+8H2O
| ||
故答案为:H2SO4;NO+6H++5e-=NH4++H2O.
看了 研究发现,NOx和SO2是雾...的网友还看了以下:
这段程序得出来的a是小数.a是车辆数,不能为小数.如何去整?sets:z/1..11/;k/1/; 2020-04-26 …
1.下列加点字注音全都正确的一项是()A.差使(chāi)狼藉(jì)簌簌(sù)浦口(pǔ)B. 2020-05-13 …
电动势E=W/q单位不一致如何解释?电动势的单位为V功的单位为J电量的单位为C由欧姆定律得V=A* 2020-05-22 …
A.σ(i+j)θr (R×S)B.σ(i+r)θj (R×S)C.σiθ(r+j) (R×S)D. 2020-05-26 …
关系模式R(S,T,J)中,每个属性均不可分,存在函数依赖有:(S,J)→T,(S,T)→J,T→J 2020-05-26 …
不能与齐齿呼、撮口呼的韵母的改变方法、规律现代汉语教材上说,把跟齐齿呼、撮口呼相拼的z,c,s,g 2020-06-08 …
现有五个球分别记作a,c,j,k,s,随机放进三个盒子,每个盒子只能放一个球,则k或s在盒中的概率 2020-06-20 …
金山词霸中AHDD.J.AHD:[s…-p½z“]D.J.[s*6pouz]K.K.[s*6poz 2020-07-04 …
1.下列加点字注音全都正确的一项是()A.差使(chāi)狼藉(jì)簌簌(sù)浦口(pǔ)B. 2020-07-11 …
声母b,p,d,t,g,k,j,q,zh,ch,sh,z,c,s中在给汉字注音时如何分辩,它们之间不 2020-11-01 …