向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中主要含硫各物种(H2S、HS-、S2-)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示
向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量.其中主要含硫各物种(H2S、HS-、S2-)的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出).下列说法不正确的是( )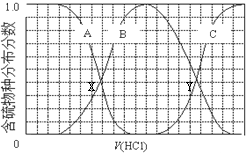
A. 含硫物种B表示HS-
B. 在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为:c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
C. X,Y为曲线的两交叉点,若能知道X点处的pH,就可以计算出H2S的Ka值
D. NaHS呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是Cu2++HS-═CuS↓+H+
故A正确;
B.C浓度一直在增加为H2S,向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,因体积相同,设Na2S、NaOH各为1mol,则n(Na)=3n(S),溶液中含硫的微粒为HS-、S2-、H2S,则c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],或溶液中存在电荷守恒得到c(Na+)=c(Cl-)+c(OH-)+c(HS-)+2c(S2-)-c(H+);
故B正确;
C.图象分析可知A为S2-,B为HS-,C表示H2S,当滴加盐酸至Y点时,表示两者含量相等,所以Ka=
| c(HS-)c(H+) |
| c(H2S) |
D.NaHS溶液中加入CuSO4溶液,硫化铜难溶于稀酸会发生反应Cu2++HS-=CuS↓+H+,溶液显示强酸性,故D正确;
故选C.
我刚刚高中毕业,参加了大学的中外合作办学班,马上要参加英语面试了大概会问自我介绍,对中外合作办学的 2020-04-11 …
在依法取得中国法人资格的中外合作经营企业中,外国合作者的投资比例一般( )。 A.不低 2020-05-17 …
根据规定。有的中外合资经营企业可以在合同中约定合营期限也可以不约定合营期限,有的中 2020-05-17 …
某中外合资经营企业的中国合营者将其在合营企业中的出资额全部转让给另一中国公司的行 2020-05-17 …
审批机关自接到中外合资经营企业的中国合营者按规定报送的全部文件之日起,决定批准或不 2020-05-17 …
甲企业为具有法人资格的中外合作经营企业,设立董事会。根据中外合作经营企业法律制度的规定,下 2020-05-17 …
根据中外合作经营企业法律制度的规定,某一具有法人资格的中外合作经营企业发生的下列事项中, 2020-05-17 …
在中华人民共和国境内履行的中外合资经营企业合同、中外合作勘探开发自然资源合同只能适用中华 2020-05-19 …
丙企业系由甲公司(中方)与乙公司(外方)共同设立的中外合资企业。ABC会计师事务所接受委托,对丙 2020-05-19 …
申请设立合资保险经纪公司的中方合资者,提出申请前5年的年末资本金不低于( )人民币。 2020-05-21 …