早教吧作业答案频道 -->化学-->
肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:(1)N2H4中N原子核外最外层达到8电子稳定结构.写出N2H4的结构式:.(2)实验室用两种固体制
题目详情
肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
(1)N2H4中N原子核外最外层达到8电子稳定结构.写出N2H4的结构式:___.
(2)实验室用两种固体制取NH3的反应化学方程式为___.
(3)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为___.
(4)肼一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为___.
(5)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2]反应的化学方程式为2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如表:
①焓变△H___0(填“>”、“<”或“=”).
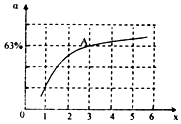
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)[n(NH3):n(CO2]=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系.α随着x增大而增大的原因是___.图中A点处,NH3的平衡转化率为___.
(6)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料,发生反应:N2(g)+3H2(g)⇌2NH3(g),测得甲容器中H2的平衡转化率为40%.
①判断乙容器中反应进行的方向是___(填“正向或“逆向”)移动.
②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为___.
(7)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:___,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是___ (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为___.
(8)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g).在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是___(填字母代号).
a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(9)如果某氨水的电离程度为1%,浓度为0.01mol/LMgCl2溶液滴加氨水至开始产生沉淀时(不考虑溶液体积变化),溶液中的NH3•H2O的浓度为___[已知Ksp[Mg(OH)2]=4.0×10-12].

(1)N2H4中N原子核外最外层达到8电子稳定结构.写出N2H4的结构式:___.
(2)实验室用两种固体制取NH3的反应化学方程式为___.
(3)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为___.
(4)肼一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为___.
(5)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2]反应的化学方程式为2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l),该反应的平衡常数和温度关系如表:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)[n(NH3):n(CO2]=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系.α随着x增大而增大的原因是___.图中A点处,NH3的平衡转化率为___.
| n(N2) | n(H2) | n(NH3) | |
| 甲 | 1mol | 3mol | 0mol |
| 乙 | 0.5mol | 1.5mol | 1mol |
| 丙 | 0mol | 0mol | 4mol |
①判断乙容器中反应进行的方向是___(填“正向或“逆向”)移动.
②达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为___.
(7)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式:___,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是___ (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为___.
(8)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g).在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是___(填字母代号).
a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(9)如果某氨水的电离程度为1%,浓度为0.01mol/LMgCl2溶液滴加氨水至开始产生沉淀时(不考虑溶液体积变化),溶液中的NH3•H2O的浓度为___[已知Ksp[Mg(OH)2]=4.0×10-12].
▼优质解答
答案和解析
(1)联氨(N2H4)中N原子与其它三个原子成键,达到8电子稳定结构,结构式为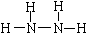 ,故答案为:
,故答案为: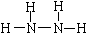 ;
;
(2)制取氨气的反应物是氯化铵与熟石灰,生成物是氯化钙、水和氨气:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑;
(3)NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(4)肼一空气燃料碱性电池中,负极上肼失电子和氢氧根离子反应生成水和氮气,电极反应式为:N2H4+4OH--4e-=4H2O+N2,故答案为:N2H4+4OH--4e-=N2+4H2O;
(5)①平衡常数随温度升高减小,说明正反应为放热反应,△H<0,故答案为:<;
②2NH3 (g)+CO2 (g)⇌CO(NH2)2 (l)+H2O (l),图象分析判断,增大氨气浓度平衡正向进行,A点处x=3,原料气中的NH3和CO2的物质的量之比为3,二氧化碳转化率为63%,假设氨气为3mol,二氧化碳为1mol,则反应的二氧化碳为0.63mol,
依据化学方程式2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l)反应的氨气为1.26mol,
NH3的平衡转化率=
×100%=42% 故答案为:c(NH3)增大,平衡正向移动; 42%;
(6)①甲、乙、丙三种方式分别投料形成的平衡不但等效也等同,甲容器平衡时N2、H2和NH3的物质的量分别为:0.6mol、1.8mol、0.8mol,则乙容器中反应进行的方向是逆向移动,故答案为:逆向;
②甲、乙是完全等效平衡,平衡时NH3的体积分数相等,丙相当于在甲平衡的基础上,再加入1molN2、3molH2,压强增大平衡向正反应方向移动,氨气的体积分数增大,故体积分数:丙>甲=乙,
故答案为:丙>甲=乙;
(7)氨气在纯氧中燃烧,生成氮气和水,化学方程式为:4NH3+5O2
2N2+6H2O,在燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:4NH3+5O2
2N2+6H2O;负极;2NH3-6e-+6OH-=N2+6H2O;
(8)4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g).在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,
a.反应是气体体积增大的反应,增大压强,反应速率增大,平衡逆向进行,故a不符合;
b.反应是放热反应,适当升高温度,反应速率增大,平衡逆向进行,故b不符合;
c.增大O2的浓度,平衡正向进行,反应速率增大,故c符合;
d.选择高效催化剂只能改变化学反应速率,但不改变化学平衡,故d不符合;
故答案为:c;
(9)如果某氨水的电离程度为1%,浓度为0.01mol/LMgCl2溶液滴加氨水至开始产生沉淀时(不考虑溶液体积变化),{已知Ksp[Mg(OH)2]=4.0×10-12]},则依据溶度积常数计算:Ksp=c(Mg2+)×c2(OH-)=4.0×10-12 ,c(Mg2+)=0.01mol/L,c(OH-)=2×10-5mol/L,氨水的浓度=
=0.002mol/L,
故答案为:0.002 mol/L.
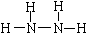 ,故答案为:
,故答案为: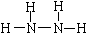 ;
;(2)制取氨气的反应物是氯化铵与熟石灰,生成物是氯化钙、水和氨气:2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(3)NH3与NaClO发生氧化还原反应可得到肼(N2H4)、氯化钠和水,所以该反应的化学方程式为:2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(4)肼一空气燃料碱性电池中,负极上肼失电子和氢氧根离子反应生成水和氮气,电极反应式为:N2H4+4OH--4e-=4H2O+N2,故答案为:N2H4+4OH--4e-=N2+4H2O;
(5)①平衡常数随温度升高减小,说明正反应为放热反应,△H<0,故答案为:<;
②2NH3 (g)+CO2 (g)⇌CO(NH2)2 (l)+H2O (l),图象分析判断,增大氨气浓度平衡正向进行,A点处x=3,原料气中的NH3和CO2的物质的量之比为3,二氧化碳转化率为63%,假设氨气为3mol,二氧化碳为1mol,则反应的二氧化碳为0.63mol,
依据化学方程式2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l)反应的氨气为1.26mol,
NH3的平衡转化率=
| 1.26mol |
| 3mol |
(6)①甲、乙、丙三种方式分别投料形成的平衡不但等效也等同,甲容器平衡时N2、H2和NH3的物质的量分别为:0.6mol、1.8mol、0.8mol,则乙容器中反应进行的方向是逆向移动,故答案为:逆向;
②甲、乙是完全等效平衡,平衡时NH3的体积分数相等,丙相当于在甲平衡的基础上,再加入1molN2、3molH2,压强增大平衡向正反应方向移动,氨气的体积分数增大,故体积分数:丙>甲=乙,
故答案为:丙>甲=乙;
(7)氨气在纯氧中燃烧,生成氮气和水,化学方程式为:4NH3+5O2
| ||
故答案为:4NH3+5O2
| ||
(8)4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g).在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,
a.反应是气体体积增大的反应,增大压强,反应速率增大,平衡逆向进行,故a不符合;
b.反应是放热反应,适当升高温度,反应速率增大,平衡逆向进行,故b不符合;
c.增大O2的浓度,平衡正向进行,反应速率增大,故c符合;
d.选择高效催化剂只能改变化学反应速率,但不改变化学平衡,故d不符合;
故答案为:c;
(9)如果某氨水的电离程度为1%,浓度为0.01mol/LMgCl2溶液滴加氨水至开始产生沉淀时(不考虑溶液体积变化),{已知Ksp[Mg(OH)2]=4.0×10-12]},则依据溶度积常数计算:Ksp=c(Mg2+)×c2(OH-)=4.0×10-12 ,c(Mg2+)=0.01mol/L,c(OH-)=2×10-5mol/L,氨水的浓度=
| 2×10-5mol/L |
| 1% |
故答案为:0.002 mol/L.
看了 肼(N2H4)和氨是氮的两种...的网友还看了以下:
如图是玉米种子的外形和结构图,据图回答问题(1)胚芽、胚轴、胚根和子叶共同组成了玉米种子的,该结构 2020-05-13 …
请写出乙醇的分子组成和结构结构式结构简式分子式官能团的名称比例模型 2020-05-14 …
部分有机物分子组成和结构的表示方法如下:甲烷乙烷丙烷丁烷戊烷分子式CH4C2H6C3H8C4H10 2020-05-14 …
高二化学(有关有机物分子式和结构式的确定)在同温同压下,某气态烃的密度为氢气密度的21倍,其中含碳 2020-05-16 …
有机化学中有机物的分子通式和结构简式通式求醇、醛、酯、醚、酚、酮、羧酸、烷烃、烯烃的分子通式和结构 2020-05-16 …
如图是玉米种子的外形和结构图.据图回答问题(1)胚芽、胚轴、胚根和子叶共同组成了玉米种子的,该结构 2020-06-26 …
下列有关物质和结构的说法不合理的是()A.组成生物大分子的每一个单体都是以若干个相连的碳原子构成的 2020-07-20 …
如图甲、乙所示为两种植物的种子结构图.(1)在大豆种子中,[]是新植物体的幼体;而玉米种子结构图中 2020-07-28 …
(2014•连云港)通过“观察种子的形态和结构“的实验,发现玉米和蚕豆种子大小、形状、颜色各不一样. 2020-11-12 …
8、V带的结构分结构和结构两种。9、带传动的传动8、V带的结构分结构和结构两种。9、带传动的传动比就 2020-12-12 …