早教吧作业答案频道 -->化学-->
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.(1)硅元素基
题目详情
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.
(1)硅元素基态原子的价电子轨道表示式为___.
(2)第四周期中,与铝未成对电子数相同的金属元素有___种.
(3)Na+和Ne互为等电子体,电离能I2(Na)___ I1(Ne)(填“>”或“<”).
(4)①已知氯有多种含氧酸,其电离平衡常数如下:
HClO4的结构简式为___,HClO3中Cl原子的杂化轨道类型为___,HClO2中含有的共价键类型为___.以上几种含氧酸的酸性强弱不同,其原因为___.
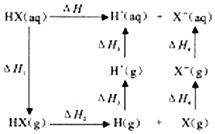
②氢卤酸(HX)的电离过程如图.△H1和△H2的递变规律都是HF>HCl>HBr>HI,其中△H1(HF)特别大的原因为___,影响△H2递变的因素为___.
(5)铝单质为面心立方晶体,晶胞参数a=q nm,铝的摩尔质量为Mg•mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA.则铝单质的密度为___ g•cm-3(列式即可,下同),铝晶胞中原子的体积占晶胞体积的百分率为___.

(1)硅元素基态原子的价电子轨道表示式为___.
(2)第四周期中,与铝未成对电子数相同的金属元素有___种.
(3)Na+和Ne互为等电子体,电离能I2(Na)___ I1(Ne)(填“>”或“<”).
(4)①已知氯有多种含氧酸,其电离平衡常数如下:
| 化学式 | HClO4 | HClO3 | HClO2 | HClO |
| Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
②氢卤酸(HX)的电离过程如图.△H1和△H2的递变规律都是HF>HCl>HBr>HI,其中△H1(HF)特别大的原因为___,影响△H2递变的因素为___.
(5)铝单质为面心立方晶体,晶胞参数a=q nm,铝的摩尔质量为Mg•mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA.则铝单质的密度为___ g•cm-3(列式即可,下同),铝晶胞中原子的体积占晶胞体积的百分率为___.
▼优质解答
答案和解析
(1)硅原子14号元素,有三个电子层,最外层4个电子,分别位于s和p亚层上,每个s轨道有两个自旋方向相反的电子,p亚层有两个电子,自旋方向相同,故价电子轨道表示式为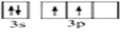 ,
,
故答案为: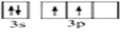 ;
;
(2)铝原子核外电子排排布为[Ne]3s23p1,未成对电子数为1,在第四周期中,与铝未成对电子数相同的金属元素有K[Ar]4s1,Cu[Ar]3d104s1,Ga[Ar]3d104s24p1,Br[Ar]3d104s24p5,未成对电子数都为1,故有4种金属元素,
故答案为:4;
(3)据钠的正电性较强对核外电子的吸引力比氖更强,要想失去电子需要跟多的能量,因此钠的第二电离能比氖的更高,
故答案为:>;
(4)①HClO4的分子中H是与O原子结合,各原子均达到稳定结构,其中Cl为+7价,O为-2价,结构式为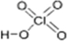 ;HClO3中Cl原子的孤对电子数为
;HClO3中Cl原子的孤对电子数为
=1,形成3个σ键杂化轨道类型为sp3;几种含氧酸的酸性强弱不同,其原因为氯的含氧酸中非羟基氧原子数目越多,中心氯原子价态越高,正电性越高,导致Cl-O-H中的电子数更向Cl偏移,越易电离出H+,
故答案为: ;sp3;σ键和π键;氯的含氧酸中非羟基氧原子数目越多,中心氯原子价态越高,正电性越高,导致Cl-O-H中的电子数更向Cl偏移,越易电离出H+;
;sp3;σ键和π键;氯的含氧酸中非羟基氧原子数目越多,中心氯原子价态越高,正电性越高,导致Cl-O-H中的电子数更向Cl偏移,越易电离出H+;
②HF分子与水分子间存在氢键,电离时需要更多能量;键能大小关系为:HF>HCl>HBr>HI,说明影响△H2递变的因素为键能,
故答案为:HF分子与水分子间存在氢键;键能;
(5)面心立方晶体中原子分布在8个顶点和6个面心,用均摊法计算一个晶胞中Al原子数为4,一个晶胞质量为
g,劲爆的体积为q3×10-21cm3,故铝单质的密度为
g•cm-3=
g•cm-3;
铝晶胞中原子的体积为4×
πr3pm3,晶胞的体积为q3×109pm3,故铝晶胞中原子的体积占晶胞体积的百分率为
,
故答案为:
;
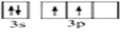 ,
,故答案为:
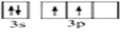 ;
;(2)铝原子核外电子排排布为[Ne]3s23p1,未成对电子数为1,在第四周期中,与铝未成对电子数相同的金属元素有K[Ar]4s1,Cu[Ar]3d104s1,Ga[Ar]3d104s24p1,Br[Ar]3d104s24p5,未成对电子数都为1,故有4种金属元素,
故答案为:4;
(3)据钠的正电性较强对核外电子的吸引力比氖更强,要想失去电子需要跟多的能量,因此钠的第二电离能比氖的更高,
故答案为:>;
(4)①HClO4的分子中H是与O原子结合,各原子均达到稳定结构,其中Cl为+7价,O为-2价,结构式为
 ;HClO3中Cl原子的孤对电子数为
;HClO3中Cl原子的孤对电子数为| 7-2+1 |
| 2 |
故答案为:
 ;sp3;σ键和π键;氯的含氧酸中非羟基氧原子数目越多,中心氯原子价态越高,正电性越高,导致Cl-O-H中的电子数更向Cl偏移,越易电离出H+;
;sp3;σ键和π键;氯的含氧酸中非羟基氧原子数目越多,中心氯原子价态越高,正电性越高,导致Cl-O-H中的电子数更向Cl偏移,越易电离出H+;②HF分子与水分子间存在氢键,电离时需要更多能量;键能大小关系为:HF>HCl>HBr>HI,说明影响△H2递变的因素为键能,
故答案为:HF分子与水分子间存在氢键;键能;
(5)面心立方晶体中原子分布在8个顶点和6个面心,用均摊法计算一个晶胞中Al原子数为4,一个晶胞质量为
| 4M |
| NA |
| ||
| q3×10-21 |
| 4M |
| NA×q3×10-21 |
铝晶胞中原子的体积为4×
| 4 |
| 3 |
4×
| ||
| q3×109 |
故答案为:
| 4M |
| NA×q3×10-21 |
4×
| ||
| q3×109 |
看了 文艺复兴时期,群青颜料曾用在...的网友还看了以下:
物质的用途是由其性质决定的,下列只利用物质物理性质的是()A.氧气供给呼吸B.氢气用作高能燃料C. 2020-04-11 …
物质的用途主要由其性质决定的.下列物质的用途与性质对应不正确的是()A.常用氮气做填充保护气--氮 2020-04-11 …
物质的用途是由其性质决定的,下列只利用物质物理性质的是()A.氧气供给呼吸B.氢气用作高能燃料C. 2020-04-11 …
设计二中关系Merchandise中由属性price表示商品价格,关系lnvoicedetail中的 2020-05-26 …
下列说法中,正确的是()A.生铁的主要成分是碳,钢的主要成分是铁B.生铁硬而脆,可铸不可锻;钢较硬 2020-06-16 …
3、物质的用途往往是由其性质决定的,下列物质的用途是根据其化学性质的是()A、用钨丝作灯泡里的灯丝 2020-07-28 …
三聚氰胺(分子式为C3H6N6)是一种工业原料,由于其含有氮元素,被不法分子用来冒充蛋白质添加在奶粉 2021-01-13 …
物质的用途往往是由其性质决定的,下列物质的用途中,根据其化学性质的是()A.用氢气充填气球B.用盐酸 2021-01-13 …
物质的用途往往是由其性质决定的,下列物质的用途是根据其化学性质的是()A.用钨丝作灯泡里的灯丝B.用 2021-01-22 …
物质的用途主要是由其性质决定的.下列用途主要是利用其化学性质的是()A.金刚石作装饰品B.铜丝作导线 2021-02-19 …