早教吧作业答案频道 -->化学-->
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,设计如下反应:I.2NO2(g)+NaCl(g)⇌NaNO3(g)+ClNO(g)△H<0,化学平衡常数为k1,II.2NO(g)+Cl2(g)⇌2ClNO(g)△H<0化学平衡常
题目详情
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,设计如下反应:
I. 2NO2(g)+NaCl(g)⇌NaNO3(g)+ClNO(g)△H<0,化学平衡常数为k1,
II.2NO(g)+Cl2(g)⇌2ClNO(g)△H<0化学平衡常数为k2
请回答下列问题:
(1)4NO2(g)+2NaCl(g)⇌2NaNO3(g)+2NO(g)+Cl2(g)的反应热△H=___ (用△H1、△H2表示),化学平衡常数K=___(用k1、k2表示)
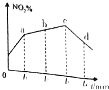
(2)若反应I在绝热密闭容器中进行,实验测得NO2(g)的转化率(NO2%)随时间变化如图所示,t3-t1时刻NO2(g)的转化率(NO2%)降低的原因是___.
(3)若反应II在恒温、恒容条件下进行,下列能判断该反应一定达到平衡状态的是___
A.容器内压强不再变化
B.n(ClNO)=n(NO)
C.混合气体密度不变
D.V正(NO)=V逆(ClNO)
(4)在一定温度和压强下,反应II达到平衡,当NO哈CL2的比例不同时,对Cl2的比例不同时,对Cl2的转化率及平衡混合物中ClNO的体积分数都有影响.设NO和Cl2起始物质的量之比为x,平衡时Cl2的转化率为a,平衡混合物中ClNO的体积分数为y,y=___.(用a和x的代数式表示y)
(5)实验室用NaOH溶液吸收NO2,反应为:2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L1的CH3COONa溶液,则两溶液中c(NO3)、c(NO2)和c(CH3COOH)由大到小的顺序为___.(已知HNO2的电离常数Ka=7.1×10-4mol•L1,CH3COOH的电离常数K a=1.7×10-5mol•L1).常温下,向溶液B中加水稀释过程中,下列比值变化大的是___.
a.
b.
c.
d.
.
I. 2NO2(g)+NaCl(g)⇌NaNO3(g)+ClNO(g)△H<0,化学平衡常数为k1,
II.2NO(g)+Cl2(g)⇌2ClNO(g)△H<0化学平衡常数为k2
请回答下列问题:

(1)4NO2(g)+2NaCl(g)⇌2NaNO3(g)+2NO(g)+Cl2(g)的反应热△H=___ (用△H1、△H2表示),化学平衡常数K=___(用k1、k2表示)
(2)若反应I在绝热密闭容器中进行,实验测得NO2(g)的转化率(NO2%)随时间变化如图所示,t3-t1时刻NO2(g)的转化率(NO2%)降低的原因是___.
(3)若反应II在恒温、恒容条件下进行,下列能判断该反应一定达到平衡状态的是___
A.容器内压强不再变化
B.n(ClNO)=n(NO)
C.混合气体密度不变
D.V正(NO)=V逆(ClNO)
(4)在一定温度和压强下,反应II达到平衡,当NO哈CL2的比例不同时,对Cl2的比例不同时,对Cl2的转化率及平衡混合物中ClNO的体积分数都有影响.设NO和Cl2起始物质的量之比为x,平衡时Cl2的转化率为a,平衡混合物中ClNO的体积分数为y,y=___.(用a和x的代数式表示y)
(5)实验室用NaOH溶液吸收NO2,反应为:2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L1的CH3COONa溶液,则两溶液中c(NO3)、c(NO2)和c(CH3COOH)由大到小的顺序为___.(已知HNO2的电离常数Ka=7.1×10-4mol•L1,CH3COOH的电离常数K a=1.7×10-5mol•L1).常温下,向溶液B中加水稀释过程中,下列比值变化大的是___.
a.
| c(H) |
| cOH |
| c(OH) |
| c(CH3COO) |
| c(Na) |
| c(CH3OO) |
| c(CH3OO)•c(H) |
| c(CH3COOH) |
▼优质解答
答案和解析
(1)已知:I. 2NO2(g)+NaCl(g)⇌NaNO3(g)+ClNO(g)△H1<0,化学平衡常数为k1,
II.2NO(g)+Cl2(g)⇌2ClNO(g)△H2<0化学平衡常数为k2
根据盖斯定律Ⅰ×2-Ⅱ可得:4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g),△H=2△H1-△H2,该反应平衡常数K=
,
故答案为:2△H1-△H2;K=
;
(2)若反应Ⅰ在绝热密闭容器中进行,2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g) K1 △H1<0,反应为放热反应,实验测得NO2( g )的转化率随时间变化的示意图中t3~t 4 时刻,NO2(g)的转化率 (NO2%)降低,因反应为放热反应且反应容器为绝热容器,随着反应的进行,体系的温度会升高,故再次达平衡时的转化率会降低,
故答案为:因反应为放热反应且反应容器为绝热容器,随着反应的进行,体系的温度会升高,故再次达平衡时的转化率会降低;
(3)2NO(g)+Cl2(g)⇌2ClNO(g) K2△H2<0,反应为气体体积减小的放热反应,
A.反应前后气体物质的量变化,容器内压强不再变化,说明反应达到平衡状态,故A正确;
B.n ( ClNO )=n ( NO )不能说明正逆反应速率相同,不能证明反应达到平衡状态,故B错误;
C.质量和体积不变,气体混合气体密度始终不变,不能说明反应达到平衡状态,故C错误;
D.反应速率之比等于化学方程式计量数之比,υ 正 ( NO )=υ 正 ( ClNO ),υ 正 ( NO )=υ 逆 ( ClNO )说明ClNO的正逆反应速率相同,故D正确;
故答案为:AD;
(4)设 NO 和 Cl2 起始物质的量之比为 x,平衡时 Cl2 的转化率为 a,结合化学三行计算列式,
2NO(g)+Cl2(g)⇌2ClNO(g)
起始量(mol) x 1 0
变化量(mol) 2a a 2a
平衡量(mol) x-2a 1-a 2a
依据平衡混合物中 ClNO 的体积分数为:y=
,
故答案为:
;
(5)0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,反应为2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液A中NaNO3物质的量浓度为0.mol/L,NaNO2物质的量为0.1mol/L,溶液B为0.1mol•L-1的CH3COONa溶液,已知HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.7×10-5mol•L-1,说明CH3COOH酸性小于HNO2的酸性,对应阴离子水解程度大,醋酸根离子和亚硝酸根离子水解,两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为:c(NO3-)>c(NO2-)>c(CH3COO-);
溶液B为0.1mol•L-1的CH3COONa溶液,常温下,向溶液 B 中加水稀释过程中,
a.稀释过程中氢氧根离子浓度减小,溶液中存在离子积常数,则氢离子浓度增大,
比值增大,故a正确;
b.加水稀释促进电离,
比值增大,故b正确;
c.溶液中加水稀释,
=
,醋酸根离子物质的量减小,比值增大,故c正确;
d.
II.2NO(g)+Cl2(g)⇌2ClNO(g)△H2<0化学平衡常数为k2
根据盖斯定律Ⅰ×2-Ⅱ可得:4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g),△H=2△H1-△H2,该反应平衡常数K=
| k12 |
| k2 |
故答案为:2△H1-△H2;K=
| k12 |
| k2 |
(2)若反应Ⅰ在绝热密闭容器中进行,2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g) K1 △H1<0,反应为放热反应,实验测得NO2( g )的转化率随时间变化的示意图中t3~t 4 时刻,NO2(g)的转化率 (NO2%)降低,因反应为放热反应且反应容器为绝热容器,随着反应的进行,体系的温度会升高,故再次达平衡时的转化率会降低,
故答案为:因反应为放热反应且反应容器为绝热容器,随着反应的进行,体系的温度会升高,故再次达平衡时的转化率会降低;
(3)2NO(g)+Cl2(g)⇌2ClNO(g) K2△H2<0,反应为气体体积减小的放热反应,
A.反应前后气体物质的量变化,容器内压强不再变化,说明反应达到平衡状态,故A正确;
B.n ( ClNO )=n ( NO )不能说明正逆反应速率相同,不能证明反应达到平衡状态,故B错误;
C.质量和体积不变,气体混合气体密度始终不变,不能说明反应达到平衡状态,故C错误;
D.反应速率之比等于化学方程式计量数之比,υ 正 ( NO )=υ 正 ( ClNO ),υ 正 ( NO )=υ 逆 ( ClNO )说明ClNO的正逆反应速率相同,故D正确;
故答案为:AD;
(4)设 NO 和 Cl2 起始物质的量之比为 x,平衡时 Cl2 的转化率为 a,结合化学三行计算列式,
2NO(g)+Cl2(g)⇌2ClNO(g)
起始量(mol) x 1 0
变化量(mol) 2a a 2a
平衡量(mol) x-2a 1-a 2a
依据平衡混合物中 ClNO 的体积分数为:y=
| 2a |
| x+1-a |
故答案为:
| 2a |
| x+1-a |
(5)0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,反应为2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液A中NaNO3物质的量浓度为0.mol/L,NaNO2物质的量为0.1mol/L,溶液B为0.1mol•L-1的CH3COONa溶液,已知HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.7×10-5mol•L-1,说明CH3COOH酸性小于HNO2的酸性,对应阴离子水解程度大,醋酸根离子和亚硝酸根离子水解,两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为:c(NO3-)>c(NO2-)>c(CH3COO-);
溶液B为0.1mol•L-1的CH3COONa溶液,常温下,向溶液 B 中加水稀释过程中,
a.稀释过程中氢氧根离子浓度减小,溶液中存在离子积常数,则氢离子浓度增大,
| c(H+) |
| c(OH-) |
b.加水稀释促进电离,
| c(OH-) |
| c(CH3COOH) |
c.溶液中加水稀释,
| c(Na+) |
| c(CH3COO-) |
| n(Na+) |
| n(CH3COO-) |
d.
| c(CH3COO-)•c(H+
作业帮用户
2017-10-09
举报

 |
看了 研究氧化物与悬浮在大气中的海...的网友还看了以下:
在化学反应MnO2+4HCl(浓)═MnCl2+2H2O+Cl2↑中,同种元素的化合价在化学反应前 2020-04-26 …
如图是某反应的微观示意图.(1)图中属于化合物的是(填化学式);(2)该反应的符号表达式为H2+C 2020-05-13 …
(1)写出电解食盐水制取Cl2的化学方程式:2NaCl+2H2O电解.2NaOH+H2↑+Cl2↑ 2020-05-14 …
老师,在含n mol FeBr2的溶液中,通入Cl2,有x mol Cl2发生反应.(1)当x=n 2020-05-17 …
关于化学反应Cl2+KOH==KCl+KClO3+KClO的问题.化学反应Cl2+KOH==KCl 2020-05-17 …
为什么当氯水与Fe2+、I—、S2—、SO32—等还原性物质发生氧化还原反应时,起反应的氧化剂是C 2020-05-21 …
因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3===2NaIO3+Cl2为什么 2020-06-04 …
当增大溶液氢离子的浓度时,氧化剂Cl2的氧化能力怎么改变? 2020-06-05 …
盐酸与氧化锰反应MnO2+4HCL(浓)=加热=MnCL2+CL2气体+2H2O这个反应中盐酸没有 2020-06-14 …
用O2将HCl转化为Cl2,可提高效益,减少污染,(2)新型RuO2催化剂对上述HCl转化为Cl2 2020-06-14 …
 扫描下载二维码
扫描下载二维码