早教吧作业答案频道 -->化学-->
含硫化合物在生产、生活中有较广泛的应用.请按要求回答下列问题.I.“保险粉”(Na2S2O4)易溶于水、难溶于乙醇,具有极强的还原性,在空气中易被氧化,在碱性介质中稳定.它的制
题目详情
含硫化合物在生产、生活中有较广泛的应用.请按要求回答下列问题.
I.“保险粉”(Na2S2O4)易溶于水、难溶于乙醇,具有极强的还原性,在空气中易被氧化,在碱性介质中稳定.它的制备工艺流程如图所示,请按要求回答下列问题.
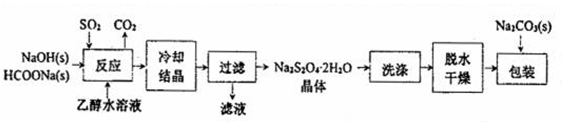
(1)“反应”在70℃条件下进行,写出发生反应的离子方程式:___.
(2)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是___.
(3)现将10mL 0.050mol/L Na2S2O4溶液在空气中放置,其溶液的pH与时间(t)的关系如图所示:(忽略溶液体积的变化).
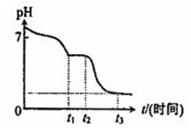
①t1~t2段溶液中S元素的化合价为___.
②t3时刻后溶液的pH为___.
Ⅱ.由工业制硫酸反应之一:2SO2(g)+O2(g)
2SO3(g),推测此反应的△S(填“>”或“<”)___0,△H(填“>”或“<”)___0.
(l)若在绝热恒容密闭容器中,通入一定量的SO2和O2,一定条件下反应,请在如下坐标中画出从开始经一段时间正反应速率[v(正)]随时间(t)的变化曲线图:
 ___
___
(2)若在相同条件下,分别投2molSO2(g)和1molO2(g) 于如下三容器中:
则三容器中反应分别平衡时K的大小关系是___;SO2的平衡转化率的大小关系是___.含硫化合物在生产、生活中有较广泛的应用.请按要求回答下列问题.
I.“保险粉”(Na2S2O4)易溶于水、难溶于乙醇,具有极强的还原性,在空气中易被氧化,在碱性介质中稳定.它的制备工艺流程如图所示,请按要求回答下列问题.

(1)“反应”在70℃条件下进行,写出发生反应的离子方程式:___.
(2)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是___.
(3)现将10mL 0.050mol/L Na2S2O4溶液在空气中放置,其溶液的pH与时间(t)的关系如图所示:(忽略溶液体积的变化).

①t1~t2段溶液中S元素的化合价为___.
②t3时刻后溶液的pH为___.
Ⅱ.由工业制硫酸反应之一:2SO2(g)+O2(g)
2SO3(g),推测此反应的△S(填“>”或“<”)___0,△H(填“>”或“<”)___0.
(l)若在绝热恒容密闭容器中,通入一定量的SO2和O2,一定条件下反应,请在如下坐标中画出从开始经一段时间正反应速率[v(正)]随时间(t)的变化曲线图:
 ___
___
(2)若在相同条件下,分别投2molSO2(g)和1molO2(g) 于如下三容器中:
则三容器中反应分别平衡时K的大小关系是___;SO2的平衡转化率的大小关系是___.
224

23
224

12
3
22
2SO3(g),推测此反应的△S(填“>”或“<”)___0,△H(填“>”或“<”)___0.
(l)若在绝热恒容密闭容器中,通入一定量的SO2和O2,一定条件下反应,请在如下坐标中画出从开始经一段时间正反应速率[v(正)]随时间(t)的变化曲线图:
 ___
___
(2)若在相同条件下,分别投2molSO2(g)和1molO2(g) 于如下三容器中:
则三容器中反应分别平衡时K的大小关系是___;SO2的平衡转化率的大小关系是___.
催化剂 加热 催化剂 催化剂 加热 加热 3
22(正)

22
绝热恒容(2L )
密闭容器A 恒温(T℃)恒容(2L)
密闭容器B 恒温(T℃)恒压
密闭容器C 平衡常数K KA KB KC SO2的平衡转化率 αA αB αC 绝热恒容(2L )
密闭容器A 恒温(T℃)恒容(2L)
密闭容器B 恒温(T℃)恒压
密闭容器C 绝热恒容(2L )
密闭容器A
恒温(T℃)恒容(2L)
密闭容器B
恒温(T℃)恒压
密闭容器C
平衡常数K KA KB KC 平衡常数K KA AKB BKC C SO2的平衡转化率 αA αB αC SO2的平衡转化率 2αA AαB BαC C2
I.“保险粉”(Na2S2O4)易溶于水、难溶于乙醇,具有极强的还原性,在空气中易被氧化,在碱性介质中稳定.它的制备工艺流程如图所示,请按要求回答下列问题.

(1)“反应”在70℃条件下进行,写出发生反应的离子方程式:___.
(2)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是___.
(3)现将10mL 0.050mol/L Na2S2O4溶液在空气中放置,其溶液的pH与时间(t)的关系如图所示:(忽略溶液体积的变化).

①t1~t2段溶液中S元素的化合价为___.
②t3时刻后溶液的pH为___.
Ⅱ.由工业制硫酸反应之一:2SO2(g)+O2(g)
| 催化剂 |
| |
| 加热 |
(l)若在绝热恒容密闭容器中,通入一定量的SO2和O2,一定条件下反应,请在如下坐标中画出从开始经一段时间正反应速率[v(正)]随时间(t)的变化曲线图:
 ___
___(2)若在相同条件下,分别投2molSO2(g)和1molO2(g) 于如下三容器中:
| 绝热恒容(2L ) 密闭容器A | 恒温(T℃)恒容(2L) 密闭容器B | 恒温(T℃)恒压 密闭容器C | |
| 平衡常数K | KA | KB | KC |
| SO2的平衡转化率 | αA | αB | αC |
I.“保险粉”(Na2S2O4)易溶于水、难溶于乙醇,具有极强的还原性,在空气中易被氧化,在碱性介质中稳定.它的制备工艺流程如图所示,请按要求回答下列问题.

(1)“反应”在70℃条件下进行,写出发生反应的离子方程式:___.
(2)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是___.
(3)现将10mL 0.050mol/L Na2S2O4溶液在空气中放置,其溶液的pH与时间(t)的关系如图所示:(忽略溶液体积的变化).

①t1~t2段溶液中S元素的化合价为___.
②t3时刻后溶液的pH为___.
Ⅱ.由工业制硫酸反应之一:2SO2(g)+O2(g)
| 催化剂 |
| |
| 加热 |
(l)若在绝热恒容密闭容器中,通入一定量的SO2和O2,一定条件下反应,请在如下坐标中画出从开始经一段时间正反应速率[v(正)]随时间(t)的变化曲线图:
 ___
___(2)若在相同条件下,分别投2molSO2(g)和1molO2(g) 于如下三容器中:
| 绝热恒容(2L ) 密闭容器A | 恒温(T℃)恒容(2L) 密闭容器B | 恒温(T℃)恒压 密闭容器C | |
| 平衡常数K | KA | KB | KC |
| SO2的平衡转化率 | αA | αB | αC |
224

23
224

12
3
22
| 催化剂 |
| |
| 加热 |
(l)若在绝热恒容密闭容器中,通入一定量的SO2和O2,一定条件下反应,请在如下坐标中画出从开始经一段时间正反应速率[v(正)]随时间(t)的变化曲线图:
 ___
___(2)若在相同条件下,分别投2molSO2(g)和1molO2(g) 于如下三容器中:
| 绝热恒容(2L ) 密闭容器A | 恒温(T℃)恒容(2L) 密闭容器B | 恒温(T℃)恒压 密闭容器C | |
| 平衡常数K | KA | KB | KC |
| SO2的平衡转化率 | αA | αB | αC |
| 催化剂 |
| |
| 加热 |
22(正)

22
| 绝热恒容(2L ) 密闭容器A | 恒温(T℃)恒容(2L) 密闭容器B | 恒温(T℃)恒压 密闭容器C | |
| 平衡常数K | KA | KB | KC |
| SO2的平衡转化率 | αA | αB | αC |
密闭容器A
密闭容器B
密闭容器C
密闭容器A
密闭容器B
密闭容器C
密闭容器A
密闭容器B
密闭容器C
▼优质解答
答案和解析
I.(1)Na22S22O44中的硫+3价,S元素的化合价由+4降为+3价,由电子得失守恒可知,HCOONa中的碳的化合价必然升高,由+2价变成+4价,生成二氧化碳,由电子、原子守恒可知反应为2HCOONa+4SO22+Na22CO33═2Na22S22O44+H22O+3CO22,其离子反应为HCOO--+OH--+2SO22=S22O442-2-+CO22+H22O,
故答案为:HCOO--+OH--+2SO22=S22O442-2-+CO22+H22O;
(2)由信息可知在碱性介质中稳定,则在包装保存“保险粉”时加入少量的Na22CO33固体,目的是Na22CO33为碱性物质,提高“保险粉”的稳定性,
故答案为:Na22CO33为碱性物质,提高“保险粉”的稳定性;
(3)Na22S22O44溶液在空气中易被氧化生成亚硫酸氢钠,则0~t11段发生离子反应方程式为2S22O442-2-+O22+2H22O=4HSO33--,t11~t22段溶液中NaHSO33电离显酸性,则t11~t22段溶液中S元素的化合价为+4价,t33时S22O442-2-被氧化生成SO442-2-,溶液的溶质为NaHSO44,由S原子守恒可知,其浓度为0.05mol/L×2=0.1mol/L,溶液的pH=1,
故答案为:+4;1;
II.2SO22(g)+O22(g)
2SO3(g)为气体体积减小的反应,且为放热反应,则此反应的△S<0,△H<0,
故答案为:<;<;
(1)绝热恒容密闭容器中,通入一定量的SO2和O2,温度升高,正反应速率增大;然后平衡逆向移动,直到达到新平衡,则从开始经一段时间正反应速率[v(正)]随时间(t)的变化曲线图为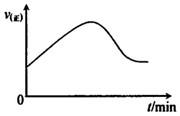 ,故答案为:
,故答案为: ;
;
(2)B、C温度相同、K相同,A中反应放热使温度升高,平衡逆向移动,则三容器中反应分别平衡时K的大小关系为KA<KB=KC;恒压时气体的体积减小,相等于加压,平衡正向移动的程度大,则B、C比较可知αB<αC,A、B的温度不同,A中升高温度平衡逆向移动,则转化率αA<αB,则SO2的平衡转化率的大小关系是αA<αB<αC,故答案为:KA<KB=KC;αA<αB<αC.
催化剂 加热 催化剂 催化剂 催化剂加热 加热 加热2SO33(g)为气体体积减小的反应,且为放热反应,则此反应的△S<0,△H<0,
故答案为:<;<;
(1)绝热恒容密闭容器中,通入一定量的SO22和O22,温度升高,正反应速率增大;然后平衡逆向移动,直到达到新平衡,则从开始经一段时间正反应速率[v(正)(正)]随时间(t)的变化曲线图为 ,故答案为:
,故答案为: ;
;
(2)B、C温度相同、K相同,A中反应放热使温度升高,平衡逆向移动,则三容器中反应分别平衡时K的大小关系为KAABB=KCC;恒压时气体的体积减小,相等于加压,平衡正向移动的程度大,则B、C比较可知αBB<αCC,A、B的温度不同,A中升高温度平衡逆向移动,则转化率αAA<αBB,则SO22的平衡转化率的大小关系是αAA<αBB<αCC,故答案为:KAABB=KCC;αAA<αBB<αCC.
故答案为:HCOO--+OH--+2SO22=S22O442-2-+CO22+H22O;
(2)由信息可知在碱性介质中稳定,则在包装保存“保险粉”时加入少量的Na22CO33固体,目的是Na22CO33为碱性物质,提高“保险粉”的稳定性,
故答案为:Na22CO33为碱性物质,提高“保险粉”的稳定性;
(3)Na22S22O44溶液在空气中易被氧化生成亚硫酸氢钠,则0~t11段发生离子反应方程式为2S22O442-2-+O22+2H22O=4HSO33--,t11~t22段溶液中NaHSO33电离显酸性,则t11~t22段溶液中S元素的化合价为+4价,t33时S22O442-2-被氧化生成SO442-2-,溶液的溶质为NaHSO44,由S原子守恒可知,其浓度为0.05mol/L×2=0.1mol/L,溶液的pH=1,
故答案为:+4;1;
II.2SO22(g)+O22(g)
| 催化剂 |
| 加热 |
故答案为:<;<;
(1)绝热恒容密闭容器中,通入一定量的SO2和O2,温度升高,正反应速率增大;然后平衡逆向移动,直到达到新平衡,则从开始经一段时间正反应速率[v(正)]随时间(t)的变化曲线图为
 ,故答案为:
,故答案为: ;
;(2)B、C温度相同、K相同,A中反应放热使温度升高,平衡逆向移动,则三容器中反应分别平衡时K的大小关系为KA<KB=KC;恒压时气体的体积减小,相等于加压,平衡正向移动的程度大,则B、C比较可知αB<αC,A、B的温度不同,A中升高温度平衡逆向移动,则转化率αA<αB,则SO2的平衡转化率的大小关系是αA<αB<αC,故答案为:KA<KB=KC;αA<αB<αC.
| 催化剂 |
| 加热 |
故答案为:<;<;
(1)绝热恒容密闭容器中,通入一定量的SO22和O22,温度升高,正反应速率增大;然后平衡逆向移动,直到达到新平衡,则从开始经一段时间正反应速率[v(正)(正)]随时间(t)的变化曲线图为
 ,故答案为:
,故答案为: ;
;(2)B、C温度相同、K相同,A中反应放热使温度升高,平衡逆向移动,则三容器中反应分别平衡时K的大小关系为KAA
看了 含硫化合物在生产、生活中有较...的网友还看了以下:
含硫化合物在生产、生活中有较广泛的应用.请按要求回答下列问题.I.“保险粉”(Na2S2O4)易溶 2020-04-06 …
下列关于氧化剂、还原剂的说法,不正确的是A.具有氧化性的物质在反应中一定做氧化剂B.氧化剂B.氧化 2020-04-26 …
观察如图原子结构示意图,回答有关问题.(1)图中具有相对稳定结构的原子是(填元素符号).(2)图中 2020-05-13 …
在自然界中,生物个体都有遗传和变异的特性,只有那些具有的个体,在生存斗争中才容易活下来,并将这些变 2020-05-14 …
《个人贷款管理暂行办法》中规定借款人无法事先确定具体交易对象且金额不超过五十万元人民币的个人 2020-05-27 …
怎样在具体语境中确定多音字“血”的读音?在小学语文课文《她是我是朋友》一文中,多次出现多音字“血” 2020-06-29 …
汤姆家中收藏有一套拿破仑三世时代的铝制餐具,这些餐具至今仍保存十分完好.这些餐具不易被锈蚀的主要原因 2020-11-04 …
若合同对于模具合格率的规定产生歧义,按照交易惯例,应该怎样理解95%以上的合格率这一条款呢?K厂是F 2020-11-28 …
从1986年7月,中国向世界贸易组织前身-关税与贸易总协定正式递交恢复合法席位的申请,到2001年加 2020-12-21 …
我们强调喜怒哀乐,不忘关心他人。主要是因为[]A.情绪具有丰富多样性B.情绪具有易波动、不稳定的特点 2020-12-22 …