早教吧作业答案频道 -->化学-->
用霞石岩(化学式为KNa3[AlSiO4]4,主要成份Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12.溶解过滤流程产生的滤液
题目详情
用霞石岩(化学式为KNa3[AlSiO4]4,主要成份Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:
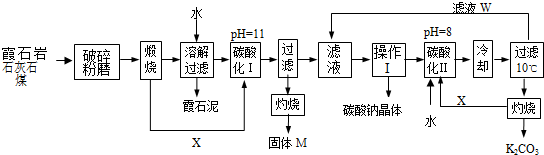
已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12.溶解过滤流程产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中.部分物质的溶解度见图.试回答下列问题: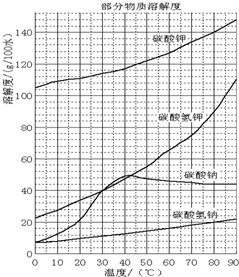
(1)霞石岩添加石灰石和煤,煤的作用是___
(2)灼烧得到固体M的化学方程式是:___.
(3)X物质是___(填化学式,下同),霞石泥的主要成分是___,滤液W中主要含有的离子有___(填三种).
(4)操作Ⅰ得到碳酸钠晶体的操作为___、___、___、洗涤、干燥.
(5)碳酸化Ⅰ中发生主要反应的离子方程式是___.
(6)碳酸化Ⅱ调整pH=8的目的是___.34422232

323

已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12.溶解过滤流程产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中.部分物质的溶解度见图.试回答下列问题:

(1)霞石岩添加石灰石和煤,煤的作用是___
(2)灼烧得到固体M的化学方程式是:___.
(3)X物质是___(填化学式,下同),霞石泥的主要成分是___,滤液W中主要含有的离子有___(填三种).
(4)操作Ⅰ得到碳酸钠晶体的操作为___、___、___、洗涤、干燥.
(5)碳酸化Ⅰ中发生主要反应的离子方程式是___.
(6)碳酸化Ⅱ调整pH=8的目的是___.34422232

323

▼优质解答
答案和解析
霞石岩加石灰石和煤粉碎煅烧碳酸钙分解产生二氧化碳即X,再用水溶解,过滤除去在滤渣霞石泥中的钙和硅等其他杂质,所得溶液碳酸化调PH值到11使溶液中的铝离子沉淀,所以过滤出的沉淀是氢氧化铝,灼烧得到的固体M为氧化铝,滤液经过蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥即得碳酸钠晶体,再将溶液碳酸化到PH值为8,所得溶液为碳酸氢钾,冷却,过滤,灼烧分解最终得到碳酸钾;
(1)由于霞石岩加石灰石和煤粉碎煅烧,煅烧需要很高的温度,所以煤的作用为:与氧气反应放热,达到煅烧的温度,故答案为:与氧气反应放热,达到煅烧的温度;
(2)溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中,所以通入CO22后一定生成氢氧化铝沉淀,灼烧则得到氧化铝,即M是氧化铝,所以灼烧得到固体M的化学方程式是2Al(OH)33
Al2O3+3H2O,故答案为:2Al(OH)3
Al2O3+3H2O.
(3)在高温下矿石、石灰石、煤混合反应生成的X可以进行碳酸的酸化,实验中X一定是CO2气体;钙和硅等其他杂质在滤渣霞石泥中,所以霞石泥主要成分是硅酸钙;滤液W可以循环使用,用来制备碳酸钠和碳酸钾,所以其中主要含有的离子有Na+、K+、HCO3-,故答案为:CO2;CaSiO3;Na+、K+、HCO3-;
(4)操作Ⅰ的目的是制备碳酸钠,根据物质的溶解度表可知,碳酸钠的溶解度随温度的升高而增大,所以操作应该是蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥,故答案为:蒸发浓缩,冷却结晶,过滤.
(5)已知NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,所以碳酸化Ⅰ中的生成物是碳酸盐,而不是碳酸氢盐,因此反应的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(6)由于NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,而碳酸氢钾灼烧生成碳酸钾,所以碳酸化Ⅱ调整pH=8的目的是使碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出,故答案为:碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出.
△ △ △ △ Al22O33+3H22O,故答案为:2Al(OH)33
Al2O3+3H2O.
(3)在高温下矿石、石灰石、煤混合反应生成的X可以进行碳酸的酸化,实验中X一定是CO2气体;钙和硅等其他杂质在滤渣霞石泥中,所以霞石泥主要成分是硅酸钙;滤液W可以循环使用,用来制备碳酸钠和碳酸钾,所以其中主要含有的离子有Na+、K+、HCO3-,故答案为:CO2;CaSiO3;Na+、K+、HCO3-;
(4)操作Ⅰ的目的是制备碳酸钠,根据物质的溶解度表可知,碳酸钠的溶解度随温度的升高而增大,所以操作应该是蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥,故答案为:蒸发浓缩,冷却结晶,过滤.
(5)已知NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,所以碳酸化Ⅰ中的生成物是碳酸盐,而不是碳酸氢盐,因此反应的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(6)由于NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,而碳酸氢钾灼烧生成碳酸钾,所以碳酸化Ⅱ调整pH=8的目的是使碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出,故答案为:碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出.
△ △ △ △ Al22O33+3H22O.
(3)在高温下矿石、石灰石、煤混合反应生成的X可以进行碳酸的酸化,实验中X一定是CO22气体;钙和硅等其他杂质在滤渣霞石泥中,所以霞石泥主要成分是硅酸钙;滤液W可以循环使用,用来制备碳酸钠和碳酸钾,所以其中主要含有的离子有Na++、K++、HCO33--,故答案为:CO22;CaSiO33;Na++、K++、HCO33--;
(4)操作Ⅰ的目的是制备碳酸钠,根据物质的溶解度表可知,碳酸钠的溶解度随温度的升高而增大,所以操作应该是蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥,故答案为:蒸发浓缩,冷却结晶,过滤.
(5)已知NaHCO33溶液的pH约为8~9,Na22CO33溶液的pH约为11~12,所以碳酸化Ⅰ中的生成物是碳酸盐,而不是碳酸氢盐,因此反应的离子方程式为2AlO22--+CO22+3H22O=2Al(OH)33↓+CO332-2-.故答案为:2AlO22--+CO22+3H22O=2Al(OH)33↓+CO332-2-.
(6)由于NaHCO33溶液的pH约为8~9,Na22CO33溶液的pH约为11~12,而碳酸氢钾灼烧生成碳酸钾,所以碳酸化Ⅱ调整pH=8的目的是使碳酸根转化为碳酸氢根离子,利于KHCO33结晶析出,故答案为:碳酸根转化为碳酸氢根离子,利于KHCO33结晶析出.
(1)由于霞石岩加石灰石和煤粉碎煅烧,煅烧需要很高的温度,所以煤的作用为:与氧气反应放热,达到煅烧的温度,故答案为:与氧气反应放热,达到煅烧的温度;
(2)溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中,所以通入CO22后一定生成氢氧化铝沉淀,灼烧则得到氧化铝,即M是氧化铝,所以灼烧得到固体M的化学方程式是2Al(OH)33
| ||
| ||
(3)在高温下矿石、石灰石、煤混合反应生成的X可以进行碳酸的酸化,实验中X一定是CO2气体;钙和硅等其他杂质在滤渣霞石泥中,所以霞石泥主要成分是硅酸钙;滤液W可以循环使用,用来制备碳酸钠和碳酸钾,所以其中主要含有的离子有Na+、K+、HCO3-,故答案为:CO2;CaSiO3;Na+、K+、HCO3-;
(4)操作Ⅰ的目的是制备碳酸钠,根据物质的溶解度表可知,碳酸钠的溶解度随温度的升高而增大,所以操作应该是蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥,故答案为:蒸发浓缩,冷却结晶,过滤.
(5)已知NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,所以碳酸化Ⅰ中的生成物是碳酸盐,而不是碳酸氢盐,因此反应的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(6)由于NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,而碳酸氢钾灼烧生成碳酸钾,所以碳酸化Ⅱ调整pH=8的目的是使碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出,故答案为:碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出.
| ||
| △ |
. |
| △ |
. |
| △ |
. |
| △ |
. |
.
.
.
.
.
| ||
(3)在高温下矿石、石灰石、煤混合反应生成的X可以进行碳酸的酸化,实验中X一定是CO2气体;钙和硅等其他杂质在滤渣霞石泥中,所以霞石泥主要成分是硅酸钙;滤液W可以循环使用,用来制备碳酸钠和碳酸钾,所以其中主要含有的离子有Na+、K+、HCO3-,故答案为:CO2;CaSiO3;Na+、K+、HCO3-;
(4)操作Ⅰ的目的是制备碳酸钠,根据物质的溶解度表可知,碳酸钠的溶解度随温度的升高而增大,所以操作应该是蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥,故答案为:蒸发浓缩,冷却结晶,过滤.
(5)已知NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,所以碳酸化Ⅰ中的生成物是碳酸盐,而不是碳酸氢盐,因此反应的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(6)由于NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12,而碳酸氢钾灼烧生成碳酸钾,所以碳酸化Ⅱ调整pH=8的目的是使碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出,故答案为:碳酸根转化为碳酸氢根离子,利于KHCO3结晶析出.
| ||
| △ |
. |
| △ |
. |
| △ |
. |
| △ |
. |
.
.
.
.
.(3)在高温下矿石、石灰石、煤混合反应生成的X可以进行碳酸的酸化,实验中X一定是CO22气体;钙和硅等其他杂质在滤渣霞石泥中,所以霞石泥主要成分是硅酸钙;滤液W可以循环使用,用来制备碳酸钠和碳酸钾,所以其中主要含有的离子有Na++、K++、HCO33--,故答案为:CO22;CaSiO33;Na++、K++、HCO33--;
(4)操作Ⅰ的目的是制备碳酸钠,根据物质的溶解度表可知,碳酸钠的溶解度随温度的升高而增大,所以操作应该是蒸发浓缩,冷却结晶,然后过滤、洗涤、干燥,故答案为:蒸发浓缩,冷却结晶,过滤.
(5)已知NaHCO33溶液的pH约为8~9,Na22CO33溶液的pH约为11~12,所以碳酸化Ⅰ中的生成物是碳酸盐,而不是碳酸氢盐,因此反应的离子方程式为2AlO22--+CO22+3H22O=2Al(OH)33↓+CO332-2-.故答案为:2AlO22--+CO22+3H22O=2Al(OH)33↓+CO332-2-.
(6)由于NaHCO33溶液的pH约为8~9,Na22CO33溶液的pH约为11~12,而碳酸氢钾灼烧生成碳酸钾,所以碳酸化Ⅱ调整pH=8的目的是使碳酸根转化为碳酸氢根离子,利于KHCO33结晶析出,故答案为:碳酸根转化为碳酸氢根离子,利于KHCO33结晶析出.
看了 用霞石岩(化学式为KNa3[...的网友还看了以下:
常温下,过氧化氢(H2O2)溶液在二氧化锰的催化作用下能迅速分解生成氧气和水.现有如图所示的实验装 2020-05-13 …
可在一台设备中实现混合、制粒、干燥工艺的有()A.挤出造粒B.干法制粒C.流化制粒D.摇摆制粒E.液 2020-05-31 …
(2014•淮安三模)工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收 2020-06-14 …
“日晓辄有丹霞流宕,照耀城头霞光万道”是什么意思日晓辄有丹霞流宕,照耀城头霞光万道这句诗出自哪里, 2020-07-04 …
某研发小组通过下列流程制备碱式次氯酸镁:(1)从上述流程中可以判断,滤液中可回收的主要物质是(2) 2020-07-29 …
氯酸钾可用于制作烟花、火柴,也可用作导弹推进剂,同时它也用于实验室制取氧气.以下是用石灰浆[Ca(O 2020-11-03 …
2011年10月29日,湖南衡阳市霞流冲煤矿发生瓦斯爆炸事故,造成29人死亡,6人受伤.遏制重特大安 2020-11-12 …
分液漏斗和长柄漏斗各有什么特点是不是有什么利弊长柄漏斗是不是会一直放液体直到没有那不是很不好吗?还有 2020-11-30 …
实验室用过氧化氢溶液制取氧气,要得到平稳氧气流的操作正确的是A.把固体的二氧化锰与过氧化氢溶液混合后 2020-12-20 …
测定亚硝酸盐含量的步骤正确的是()A.制备标准显色液→制备溶液→制备样品处理液→比色B.制备标准显色 2021-01-22 …