早教吧作业答案频道 -->化学-->
氯酸钾是常见的氧化剂,用于制造火药、烟火,工业上用石灰乳氯化法制备氯酸钾的流程如图所示:已知:氯化过程主要发生反应6Ca(OH)2+6Cl2△5CaCl2+Ca
题目详情
氯酸钾是常见的氧化剂,用于制造火药、烟火,工业上用石灰乳氯化法制备氯酸钾的流程如图所示:
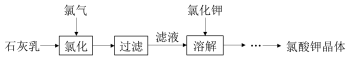
已知:氯化过程主要发生反应 6Ca(OH)2+6Cl2
5CaCl2+Ca(ClO3)2+6H2O
完成下列填空:
(1)工业生产氯气的方法是___.
(2)氯化过程需要控制较高温度,其目的有:
①___; ②减少 Cl2与 Ca(OH)2之间的副反应.
(3)向热的滤液中加入稍过量的氯化钾,待溶解完全后进行冷却,有大量氯酸钾晶体析出,写出相关反应
的化学方程式:___.
得到的氯酸钾晶体中可能会含有少量氯化钾,进一步提纯的方法是___.
(4)为测定所得晶体中氯酸钾的纯度,将 a g 样品与 b g 二氧化锰混合,加热该混合物一段时间后(杂质
不参加反应)冷却,称量剩余固体质量,重复加热、冷却、称量操作,记录数据如表:
①进行加热操作时,应将固体置于___(填仪器名称)中.
②该实验不必进行第五次加热的原因是___.
③若某次测定结果的相对误差为-2.98%,写出导致这一结果的一种可能情况.___.氯酸钾是常见的氧化剂,用于制造火药、烟火,工业上用石灰乳氯化法制备氯酸钾的流程如图所示:

已知:氯化过程主要发生反应 6Ca(OH)2+6Cl2
5CaCl2+Ca(ClO3)2+6H2O
完成下列填空:
(1)工业生产氯气的方法是___.
(2)氯化过程需要控制较高温度,其目的有:
①___; ②减少 Cl2与 Ca(OH)2之间的副反应.
(3)向热的滤液中加入稍过量的氯化钾,待溶解完全后进行冷却,有大量氯酸钾晶体析出,写出相关反应
的化学方程式:___.
得到的氯酸钾晶体中可能会含有少量氯化钾,进一步提纯的方法是___.
(4)为测定所得晶体中氯酸钾的纯度,将 a g 样品与 b g 二氧化锰混合,加热该混合物一段时间后(杂质
不参加反应)冷却,称量剩余固体质量,重复加热、冷却、称量操作,记录数据如表:
①进行加热操作时,应将固体置于___(填仪器名称)中.
②该实验不必进行第五次加热的原因是___.
③若某次测定结果的相对误差为-2.98%,写出导致这一结果的一种可能情况.___.

22
5CaCl2+Ca(ClO3)2+6H2O
完成下列填空:
(1)工业生产氯气的方法是___.
(2)氯化过程需要控制较高温度,其目的有:
①___; ②减少 Cl2与 Ca(OH)2之间的副反应.
(3)向热的滤液中加入稍过量的氯化钾,待溶解完全后进行冷却,有大量氯酸钾晶体析出,写出相关反应
的化学方程式:___.
得到的氯酸钾晶体中可能会含有少量氯化钾,进一步提纯的方法是___.
(4)为测定所得晶体中氯酸钾的纯度,将 a g 样品与 b g 二氧化锰混合,加热该混合物一段时间后(杂质
不参加反应)冷却,称量剩余固体质量,重复加热、冷却、称量操作,记录数据如表:
①进行加热操作时,应将固体置于___(填仪器名称)中.
②该实验不必进行第五次加热的原因是___.
③若某次测定结果的相对误差为-2.98%,写出导致这一结果的一种可能情况.___.
△ △ △ 2322
22
加热次数 第一次 第二次 第三次 第四次 剩余固体质量(g) c d e e 加热次数 第一次 第二次 第三次 第四次 加热次数 第一次 第二次 第三次 第四次 剩余固体质量(g) c d e e 剩余固体质量(g) c d e e

已知:氯化过程主要发生反应 6Ca(OH)2+6Cl2
| △ |
| |
完成下列填空:
(1)工业生产氯气的方法是___.
(2)氯化过程需要控制较高温度,其目的有:
①___; ②减少 Cl2与 Ca(OH)2之间的副反应.
(3)向热的滤液中加入稍过量的氯化钾,待溶解完全后进行冷却,有大量氯酸钾晶体析出,写出相关反应
的化学方程式:___.
得到的氯酸钾晶体中可能会含有少量氯化钾,进一步提纯的方法是___.
(4)为测定所得晶体中氯酸钾的纯度,将 a g 样品与 b g 二氧化锰混合,加热该混合物一段时间后(杂质
不参加反应)冷却,称量剩余固体质量,重复加热、冷却、称量操作,记录数据如表:
| 加热次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | c | d | e | e |
②该实验不必进行第五次加热的原因是___.
③若某次测定结果的相对误差为-2.98%,写出导致这一结果的一种可能情况.___.氯酸钾是常见的氧化剂,用于制造火药、烟火,工业上用石灰乳氯化法制备氯酸钾的流程如图所示:

已知:氯化过程主要发生反应 6Ca(OH)2+6Cl2
| △ |
| |
完成下列填空:
(1)工业生产氯气的方法是___.
(2)氯化过程需要控制较高温度,其目的有:
①___; ②减少 Cl2与 Ca(OH)2之间的副反应.
(3)向热的滤液中加入稍过量的氯化钾,待溶解完全后进行冷却,有大量氯酸钾晶体析出,写出相关反应
的化学方程式:___.
得到的氯酸钾晶体中可能会含有少量氯化钾,进一步提纯的方法是___.
(4)为测定所得晶体中氯酸钾的纯度,将 a g 样品与 b g 二氧化锰混合,加热该混合物一段时间后(杂质
不参加反应)冷却,称量剩余固体质量,重复加热、冷却、称量操作,记录数据如表:
| 加热次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | c | d | e | e |
②该实验不必进行第五次加热的原因是___.
③若某次测定结果的相对误差为-2.98%,写出导致这一结果的一种可能情况.___.

22
| △ |
| |
完成下列填空:
(1)工业生产氯气的方法是___.
(2)氯化过程需要控制较高温度,其目的有:
①___; ②减少 Cl2与 Ca(OH)2之间的副反应.
(3)向热的滤液中加入稍过量的氯化钾,待溶解完全后进行冷却,有大量氯酸钾晶体析出,写出相关反应
的化学方程式:___.
得到的氯酸钾晶体中可能会含有少量氯化钾,进一步提纯的方法是___.
(4)为测定所得晶体中氯酸钾的纯度,将 a g 样品与 b g 二氧化锰混合,加热该混合物一段时间后(杂质
不参加反应)冷却,称量剩余固体质量,重复加热、冷却、称量操作,记录数据如表:
| 加热次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | c | d | e | e |
②该实验不必进行第五次加热的原因是___.
③若某次测定结果的相对误差为-2.98%,写出导致这一结果的一种可能情况.___.
| △ |
| |
22
| 加热次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | c | d | e | e |
▼优质解答
答案和解析
(1)工业用电解饱和食盐水的方法生产氯气,故答案为:电解饱和食盐水;(2)为加快反应速率,减少 Cl2与 Ca(OH)2之间发生副反应生产次氯酸钙,氯化过程升高温度;故答案为:加快反应速率;(3)热的氯...
看了 氯酸钾是常见的氧化剂,用于制...的网友还看了以下:
5、工业上用氨碱法制纯碱,制取过程如下:精制吸氨碳酸化①盐水(2)\x05上述制取过程中的化学反应 2020-07-03 …
氨碱工业,如图是海水“制碱”的部分简单流程.(1)步骤Ⅳ反应的化学方程式为:.(2)制氨盐水的过程 2020-07-22 …
(9分)实验室里用乙醇和浓硫酸反应生成乙烯,乙烯再与澳反应制1,2一二溴乙烷。在制备过程中部分乙醇 2020-07-29 …
工业上可采用电化学法利用H2S废气制取氢气,该法制氢过程的示意图如图所示,回答下列问题:(1)产生 2020-08-01 …
怎么用Mg(HCO3)2制MgCO3?与NaOH反应:氢氧化钠少量:Mg(HCO3)2+2NaOH= 2020-11-01 …
实验室里用乙醇和浓硫酸反应生成乙烯,乙烯再与溴反应制1,2-二溴乙烷.在制备过程中部分乙醇被浓硫酸氧 2020-11-02 …
请生物高手帮忙,谢谢!1.将刚煮熟的米饭直接与酒曲混合,行不行?为什么?2.制作过程中为什么要将容器 2020-11-22 …
以电石渣为原料制备KClO3的流程如图1:(1)氯化过程控制电石渣过量,在75℃左右进行.氯化时存在 2020-12-05 …
工业上可用纯碱和石灰石为原料制取烧碱,请你写出制取过程中发生反应的化学方程式.(1)分解反应CaCO 2021-02-01 …
实验室里用乙醇和浓硫酸反应生成乙烯,乙烯再与澳反应制1,2一二溴乙烷.在制备过程中部分乙醇被浓硫酸氧 2021-02-01 …