早教吧作业答案频道 -->化学-->
实验室用50mL0.50mol•L-1盐酸、50mL0.55mol•L-1NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:实验次数起始温度t1/℃终止温度t2/℃盐酸NaOH溶液120.
题目详情
实验室用50mL 0.50 mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
完成下列问题:
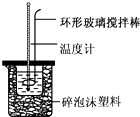
(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是___.
(2)在操作正确的前提下,提高中和热测定准确性的关键是___.大烧杯如不盖硬纸板,求得的中和热数值将___(填“偏大”、“偏小”或“无影响”).结合日常生活实际该实验在___中(家用产品)效果更好.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=___[盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容(c)按4.18J•(g•℃)-1计算].
(4)如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将____(填“偏大”、“偏小”、“不变”).如改用60mL0.5mol/L的盐酸与50mL 0.55mol•L-1 的NaOH 溶液进行反应,与上述实验相比,所放出的热量___(填“相等”或“不相等”),所求中和热___(填“相等”或“不相等”).
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是___.
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.-1-1
实验次数 起始温度t1/℃ 终止温度t2/℃ 盐酸 NaOH溶液 1 20.2 20.3 23.7 2 2 20.3 20.5 23.8 3 21.5 21.6 24.9 实验次数 起始温度t1/℃ 终止温度t2/℃ 实验次数 起始温度t1/℃ 1终止温度t2/℃ 2 盐酸 NaOH溶液 盐酸 NaOH溶液 1 20.2 20.3 23.7 1 20.2 20.3 23.7 2 2 20.3 20.5 23.8 2 2 20.3 20.5 23.8 3 21.5 21.6 24.9 3 21.5 21.6 24.9

-3-1
-1
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |

(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是___.
(2)在操作正确的前提下,提高中和热测定准确性的关键是___.大烧杯如不盖硬纸板,求得的中和热数值将___(填“偏大”、“偏小”或“无影响”).结合日常生活实际该实验在___中(家用产品)效果更好.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=___[盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容(c)按4.18J•(g•℃)-1计算].
(4)如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将____(填“偏大”、“偏小”、“不变”).如改用60mL0.5mol/L的盐酸与50mL 0.55mol•L-1 的NaOH 溶液进行反应,与上述实验相比,所放出的热量___(填“相等”或“不相等”),所求中和热___(填“相等”或“不相等”).
(5)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是___.
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.-1-1
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |

-3-1
-1
▼优质解答
答案和解析
(1)不能将环形玻璃搅拌棒改为铜丝搅拌棒,因为铜丝搅拌棒是热的良导体;
故答案为:Cu传热快,热量损失大;
(2)在中和反应中,必须确保热量不散失,应提高装置的保温效果;大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小;在日常生活实际该实验在保温杯中效果更好;
故答案为:提高装置的保温效果;偏小;保温杯;
(3)第1次实验盐酸和NaOH溶液起始平均温度为20.25℃,反应前后温度差为:3.45℃;
第2次实验盐酸和NaOH溶液起始平均温度为20.40℃,反应前后温度差为:3.40℃;
第3次实验盐酸和NaOH溶液起始平均温度为21.55℃,反应前后温度差为:3.35℃;
三次温度差的平均值为3.40℃,
50mL 0.50 mol•L-1-1盐酸、50mL 0.55mol•L-1-1 NaOH溶液的质量m=100mL×1g/mL=100g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g×3.40℃=1421.2J=1.4212KJ,即生成0.025mol的水放出热量1.4212KJ,所以生成1mol的水放出热量为
=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
(4)氢氧化钠固体溶于水,放出热量,所以实验中测得的“中和热”数值将偏大;反应放出的热量和所用酸以及碱的量的多少有关,改用60mL0.5mol/L的盐酸与50mL 0.55mol•L-1 的NaOH 溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但中和热是指稀强酸与稀强碱发生中和反应生成1molH2O放出的热量,与酸碱的用量无关,测得中和热数值相等,
故答案为:偏大,不相等,相等;
(5)A.测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,导致实验测得中和热的数值偏小,故A正确;
B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失,导致实验测得中和热的数值偏小,故B正确;
C、做本实验的室温和反应热的数据之间无关,故C错误;
D、将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水,由于氨水是弱碱,弱碱电离要吸热,导致实验测得中和热的数值偏小,故D正确;
E、在量取盐酸时仰视计数,会使得实际量取体积高于所要量的体积,算过量,可以保证碱全反应,导致实验测得中和热的数值偏高,故E错误;
F、大烧杯的盖板中间小孔太大,会导致一部分能量散失,导致实验测得中和热的数值偏小,故F正确;
故选:ABDF.
1.4212kJ×1mol 0.025mol 1.4212kJ×1mol 1.4212kJ×1mol 1.4212kJ×1mol0.025mol 0.025mol 0.025mol=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
(4)氢氧化钠固体溶于水,放出热量,所以实验中测得的“中和热”数值将偏大;反应放出的热量和所用酸以及碱的量的多少有关,改用60mL0.5mol/L的盐酸与50mL 0.55mol•L-1-1 的NaOH 溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但中和热是指稀强酸与稀强碱发生中和反应生成1molH22O放出的热量,与酸碱的用量无关,测得中和热数值相等,
故答案为:偏大,不相等,相等;
(5)A.测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,导致实验测得中和热的数值偏小,故A正确;
B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失,导致实验测得中和热的数值偏小,故B正确;
C、做本实验的室温和反应热的数据之间无关,故C错误;
D、将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水,由于氨水是弱碱,弱碱电离要吸热,导致实验测得中和热的数值偏小,故D正确;
E、在量取盐酸时仰视计数,会使得实际量取体积高于所要量的体积,算过量,可以保证碱全反应,导致实验测得中和热的数值偏高,故E错误;
F、大烧杯的盖板中间小孔太大,会导致一部分能量散失,导致实验测得中和热的数值偏小,故F正确;
故选:ABDF.
故答案为:Cu传热快,热量损失大;
(2)在中和反应中,必须确保热量不散失,应提高装置的保温效果;大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小;在日常生活实际该实验在保温杯中效果更好;
故答案为:提高装置的保温效果;偏小;保温杯;
(3)第1次实验盐酸和NaOH溶液起始平均温度为20.25℃,反应前后温度差为:3.45℃;
第2次实验盐酸和NaOH溶液起始平均温度为20.40℃,反应前后温度差为:3.40℃;
第3次实验盐酸和NaOH溶液起始平均温度为21.55℃,反应前后温度差为:3.35℃;
三次温度差的平均值为3.40℃,
50mL 0.50 mol•L-1-1盐酸、50mL 0.55mol•L-1-1 NaOH溶液的质量m=100mL×1g/mL=100g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g×3.40℃=1421.2J=1.4212KJ,即生成0.025mol的水放出热量1.4212KJ,所以生成1mol的水放出热量为
| 1.4212kJ×1mol |
| 0.025mol |
故答案为:-56.8kJ/mol;
(4)氢氧化钠固体溶于水,放出热量,所以实验中测得的“中和热”数值将偏大;反应放出的热量和所用酸以及碱的量的多少有关,改用60mL0.5mol/L的盐酸与50mL 0.55mol•L-1 的NaOH 溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但中和热是指稀强酸与稀强碱发生中和反应生成1molH2O放出的热量,与酸碱的用量无关,测得中和热数值相等,
故答案为:偏大,不相等,相等;
(5)A.测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,导致实验测得中和热的数值偏小,故A正确;
B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失,导致实验测得中和热的数值偏小,故B正确;
C、做本实验的室温和反应热的数据之间无关,故C错误;
D、将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水,由于氨水是弱碱,弱碱电离要吸热,导致实验测得中和热的数值偏小,故D正确;
E、在量取盐酸时仰视计数,会使得实际量取体积高于所要量的体积,算过量,可以保证碱全反应,导致实验测得中和热的数值偏高,故E错误;
F、大烧杯的盖板中间小孔太大,会导致一部分能量散失,导致实验测得中和热的数值偏小,故F正确;
故选:ABDF.
| 1.4212kJ×1mol |
| 0.025mol |
故答案为:-56.8kJ/mol;
(4)氢氧化钠固体溶于水,放出热量,所以实验中测得的“中和热”数值将偏大;反应放出的热量和所用酸以及碱的量的多少有关,改用60mL0.5mol/L的盐酸与50mL 0.55mol•L-1-1 的NaOH 溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但中和热是指稀强酸与稀强碱发生中和反应生成1molH22O放出的热量,与酸碱的用量无关,测得中和热数值相等,
故答案为:偏大,不相等,相等;
(5)A.测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,导致实验测得中和热的数值偏小,故A正确;
B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失,导致实验测得中和热的数值偏小,故B正确;
C、做本实验的室温和反应热的数据之间无关,故C错误;
D、将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水,由于氨水是弱碱,弱碱电离要吸热,导致实验测得中和热的数值偏小,故D正确;
E、在量取盐酸时仰视计数,会使得实际量取体积高于所要量的体积,算过量,可以保证碱全反应,导致实验测得中和热的数值偏高,故E错误;
F、大烧杯的盖板中间小孔太大,会导致一部分能量散失,导致实验测得中和热的数值偏小,故F正确;
故选:ABDF.
看了 实验室用50mL0.50mo...的网友还看了以下:
配制100g10%的氯化钠溶液,下列操作不会导致质量分数变化的是()A.用蒸馏水润洗用于盛装溶液的 2020-05-14 …
在配制10%氯化钠溶液的过程中,会导致溶液中氯化钠的质量分数大于10%的原因可能是()A.用量筒量 2020-05-14 …
在配制10%氯化钠溶液的过程中,会导致溶液中氯化钠的质量分数大于10%的原因可能是()A.用量筒量 2020-05-14 …
为什么“容量瓶用蒸馏水洗净后,在用待装溶液润洗”这句话是错的?待装溶液指的是什么?,烧杯中的溶液? 2020-05-16 …
如图所示,装置BO′O可绕竖直轴O′O转动,可视为质点的小球A与两细线连接后分别系于B、C两点,装 2020-06-25 …
(12分)如图所示,装置BO′O可绕竖直轴O′O转动,可视为质点的小球A与两细线连接后分别系于B、 2020-06-29 …
食品加工厂准备把一批新酿的醋装瓶运往商店.每瓶溶量/mL2505007501500数量/瓶1200 2020-06-30 …
紧急求助一条大学物理化学题,关于凝固点的.在273.15K,O₂和N₂的压力均为101.325kP 2020-07-18 …
过氧化氢的水溶液俗称双氧水,在放置过程中会缓慢分解,化学方程式为:。现有一瓶未曾使用过的、久置的双氧 2020-11-23 …
过氧化氢的水溶液俗称双氧水,在放置过程中会缓慢分解.现有一瓶未曾使用过的、久置的双氧水,瓶上标签提供 2020-11-23 …