早教吧作业答案频道 -->化学-->
50mL0.5mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少一种玻璃
题目详情
50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
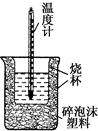
(1)从实验装置上看,图中尚缺少一种玻璃仪器是___.
(2)大烧杯上如不盖硬纸板,测得的中和热___(填“偏大”或“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol•L-1盐酸跟50mL 0.50mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量___(填“偏大”或“相等”或“偏小”),所求中和热___(填“相等”或“不相等”),简述理由:___.
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会___;用50mL 0.5mol•L-1盐酸与50mL 0.50mol•L-1 NaOH溶液进行中和测定,测得的中和热数值会___.(填“偏大”、“偏小”或“无影响”)
(5)取50mL 0.50mol/L NaOH溶液和30mL0.50mol/L硫酸溶液进行实验,实验数据如下表.
则中和热△H=___(取小数点后一位).
(本题中NaOH溶液和硫酸溶液的密度均取1g/mL,溶液的比热容均取4.2J/(g.℃)) 50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:

(1)从实验装置上看,图中尚缺少一种玻璃仪器是___.
(2)大烧杯上如不盖硬纸板,测得的中和热___(填“偏大”或“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol•L-1盐酸跟50mL 0.50mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量___(填“偏大”或“相等”或“偏小”),所求中和热___(填“相等”或“不相等”),简述理由:___.
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会___;用50mL 0.5mol•L-1盐酸与50mL 0.50mol•L-1 NaOH溶液进行中和测定,测得的中和热数值会___.(填“偏大”、“偏小”或“无影响”)
(5)取50mL 0.50mol/L NaOH溶液和30mL0.50mol/L硫酸溶液进行实验,实验数据如下表.
则中和热△H=___(取小数点后一位).
(本题中NaOH溶液和硫酸溶液的密度均取1g/mL,溶液的比热容均取4.2J/(g.℃))-1-1

-1-1
-1-1
温度
实验次数
起始温度T1/℃ 终止温度T2/℃
温度差平均值(T2-T1)/℃
H2SO4 NaOH 平均值 1 26.2 26.0 30.1 2 27.0 27.4 33.3 3 25.9 25.9 29.8 4 26.4 26.2 30.4 温度
实验次数
起始温度T1/℃ 终止温度T2/℃
温度差平均值(T2-T1)/℃
温度
实验次数
起始温度T1/℃ 1终止温度T2/℃
温度差平均值(T2-T1)/℃
21
H2SO4 NaOH 平均值 H2SO4 24NaOH 平均值 1 26.2 26.0 30.1 1 26.2 26.0 30.1 2 27.0 27.4 33.3 2 27.0 27.4 33.3 3 25.9 25.9 29.8 3 25.9 25.9 29.8 4 26.4 26.2 30.4 4 26.4 26.2 30.4

(1)从实验装置上看,图中尚缺少一种玻璃仪器是___.
(2)大烧杯上如不盖硬纸板,测得的中和热___(填“偏大”或“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol•L-1盐酸跟50mL 0.50mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量___(填“偏大”或“相等”或“偏小”),所求中和热___(填“相等”或“不相等”),简述理由:___.
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会___;用50mL 0.5mol•L-1盐酸与50mL 0.50mol•L-1 NaOH溶液进行中和测定,测得的中和热数值会___.(填“偏大”、“偏小”或“无影响”)
(5)取50mL 0.50mol/L NaOH溶液和30mL0.50mol/L硫酸溶液进行实验,实验数据如下表.
| 温度 实验次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值(T2-T1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 30.1 | ||
| 2 | 27.0 | 27.4 | 33.3 | ||
| 3 | 25.9 | 25.9 | 29.8 | ||
| 4 | 26.4 | 26.2 | 30.4 | ||
(本题中NaOH溶液和硫酸溶液的密度均取1g/mL,溶液的比热容均取4.2J/(g.℃)) 50mL 0.5mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:

(1)从实验装置上看,图中尚缺少一种玻璃仪器是___.
(2)大烧杯上如不盖硬纸板,测得的中和热___(填“偏大”或“偏小”或“无影响”).
(3)实验中改用60mL 0.50mol•L-1盐酸跟50mL 0.50mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量___(填“偏大”或“相等”或“偏小”),所求中和热___(填“相等”或“不相等”),简述理由:___.
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会___;用50mL 0.5mol•L-1盐酸与50mL 0.50mol•L-1 NaOH溶液进行中和测定,测得的中和热数值会___.(填“偏大”、“偏小”或“无影响”)
(5)取50mL 0.50mol/L NaOH溶液和30mL0.50mol/L硫酸溶液进行实验,实验数据如下表.
| 温度 实验次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值(T2-T1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 30.1 | ||
| 2 | 27.0 | 27.4 | 33.3 | ||
| 3 | 25.9 | 25.9 | 29.8 | ||
| 4 | 26.4 | 26.2 | 30.4 | ||
(本题中NaOH溶液和硫酸溶液的密度均取1g/mL,溶液的比热容均取4.2J/(g.℃))-1-1

-1-1
-1-1
| 温度 实验次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值(T2-T1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 30.1 | ||
| 2 | 27.0 | 27.4 | 33.3 | ||
| 3 | 25.9 | 25.9 | 29.8 | ||
| 4 | 26.4 | 26.2 | 30.4 | ||
实验次数
实验次数
实验次数
▼优质解答
答案和解析
(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,
故答案为:环形玻璃搅拌棒;
(2)大烧杯上如不盖硬纸板,会使一部分热量散失,但中和热为负值,所以测得的中和热偏大;
故答案为:偏大;
(3)反应放出的热量和所用酸以及碱的量的多少有关,改用60mL 0.50mol•L-1-1盐酸跟50mL 0.50mol•L-1-1 NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以改用60mL 0.50mol•L-1-1盐酸跟50mL 0.50mol•L-1-1 NaOH溶液进行上述实验,测得中和热数值相等;
故答案为:不相等;相等;因中和热是指稀强酸与稀强碱发生中和反应生成1molH22O放出的热量,与酸碱的用量无关;
(4)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小,中和热数值会偏小;中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关,所以用50mL 0.5mol•L-1-1盐酸与50mL 0.50mol•L-1-1 NaOH溶液进行上述实验,测得的中和热的数值无影响;
故答案为:偏小;无影响;
(5)第1次实验盐酸和NaOH溶液起始平均温度为26.1℃,反应后温度为30.1℃,反应前后温度差为4.0℃;
第2次实验盐酸和NaOH溶液起始平均温度为27.2℃,反应后温度为33.3℃,反应前后温度差为:6.1℃;
第3次实验盐酸和NaOH溶液起始平均温度为25.9℃,反应后温度为29.8℃,反应前后温度差为:3.9℃;
第4次实验盐酸和NaOH溶液起始平均温度为26.3℃,反应后温度为30.4℃,反应前后温度差为:4.1℃;
第2组数据相差较大,舍去,三次试验的平均值为4.0℃;
取50mL 0.50mol/L NaOH溶液和30mL0.50mol/L硫酸溶液进行实验,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为80mL×1g/cm33=80g,温度变化的值为△T=4.0℃,则生成0.025mol水放出的热量为Q=m•c•△T=80g×4.2J/(g•℃)×4.0℃=1344J,即1.344KJ,所以实验测得的中和热△H=-
=-53.8kJ/mol;
故答案为:-53.8kJ/mol.
1.344KJ 0.025mol 1.344KJ 1.344KJ 1.344KJ0.025mol 0.025mol 0.025mol=-53.8kJ/mol;
故答案为:-53.8kJ/mol.
故答案为:环形玻璃搅拌棒;
(2)大烧杯上如不盖硬纸板,会使一部分热量散失,但中和热为负值,所以测得的中和热偏大;
故答案为:偏大;
(3)反应放出的热量和所用酸以及碱的量的多少有关,改用60mL 0.50mol•L-1-1盐酸跟50mL 0.50mol•L-1-1 NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以改用60mL 0.50mol•L-1-1盐酸跟50mL 0.50mol•L-1-1 NaOH溶液进行上述实验,测得中和热数值相等;
故答案为:不相等;相等;因中和热是指稀强酸与稀强碱发生中和反应生成1molH22O放出的热量,与酸碱的用量无关;
(4)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小,中和热数值会偏小;中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关,所以用50mL 0.5mol•L-1-1盐酸与50mL 0.50mol•L-1-1 NaOH溶液进行上述实验,测得的中和热的数值无影响;
故答案为:偏小;无影响;
(5)第1次实验盐酸和NaOH溶液起始平均温度为26.1℃,反应后温度为30.1℃,反应前后温度差为4.0℃;
第2次实验盐酸和NaOH溶液起始平均温度为27.2℃,反应后温度为33.3℃,反应前后温度差为:6.1℃;
第3次实验盐酸和NaOH溶液起始平均温度为25.9℃,反应后温度为29.8℃,反应前后温度差为:3.9℃;
第4次实验盐酸和NaOH溶液起始平均温度为26.3℃,反应后温度为30.4℃,反应前后温度差为:4.1℃;
第2组数据相差较大,舍去,三次试验的平均值为4.0℃;
取50mL 0.50mol/L NaOH溶液和30mL0.50mol/L硫酸溶液进行实验,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为80mL×1g/cm33=80g,温度变化的值为△T=4.0℃,则生成0.025mol水放出的热量为Q=m•c•△T=80g×4.2J/(g•℃)×4.0℃=1344J,即1.344KJ,所以实验测得的中和热△H=-
| 1.344KJ |
| 0.025mol |
故答案为:-53.8kJ/mol.
| 1.344KJ |
| 0.025mol |
故答案为:-53.8kJ/mol.
看了 50mL0.5mol•L-1...的网友还看了以下:
一瓶盐水重420克,其中盐占盐水的二十一分之一,盐与水的比是(),其中盐有()克,如果再添10克盐 2020-05-13 …
三个相同容器中各装满盐水,第一个容器中盐与水的比是1:7,第二个容器中盐与水的比是2:5,第三个容 2020-05-21 …
一杯盐水的质量是360克,其中盐的质量是水的四分之一,这杯盐水中,盐与盐水的质量比是():(),这 2020-05-21 …
如图所示,在烧杯中加入盐水,然后将连在电压表上的铜片和锌片插入盐水中,这样就制成了一个盐水电池.观 2020-07-08 …
写出下面各个杯子中盐和水的比?(单位:克)并算一算那个杯子中水最咸呢一号:盐50水100二号:盐2 2020-07-11 …
一瓶盐水,将其中盐的25%换成水,同时将其中水的25%换成盐,这时这瓶盐溶液的浓度为70%,问原盐 2020-07-12 …
一杯盐水重400克,其中盐和水的比是1:191)现在要把这杯盐水冲淡,使得盐和水的比是1:25,需 2020-07-18 …
有甲乙两瓶盐水溶液,乙瓶的体积是甲瓶的4/5甲瓶中盐和水的比是1:3,乙瓶中盐和水的比是3:7,现 2020-07-26 …
等差数列公式我要所有的!要中文中文!中文中文中文中文中文中文中文中文中文中文中文中文中文中文中文中文 2020-12-03 …
把一千克的水加到一桶盐水中,这时盐水含盐10%,再把1千克的盐加进去,则盐水中含盐12%把一千克的水 2020-12-17 …