早教吧作业答案频道 -->化学-->
以煤为主要原料可以制备乙二醇,相关工艺流程如下:(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式(2)合成气在不同催化剂作用下,可以合成不同的物质.下列物质仅
题目详情
以煤为主要原料可以制备乙二醇,相关工艺流程如下:
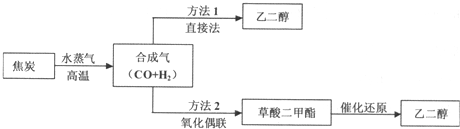
(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式___
(2)合成气在不同催化剂作用下,可以合成不同的物质.下列物质仅用合成气为原料就能得到且原子利用率为100%的是___(填字母).
A.草酸( HOOC-COOH) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
(3)工业上还可以利用天然气(主要成分为CH.)与C02反应制备合成气.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
2CO(g)+O2(g)═2CO2(g)△H=-566.kJ/mol
则CH4与CO2生成合成气的热化学方程式为___.
(4)方法2:在恒容密闭容器中投入草酸二甲酯和H2发生如下反应:CH3OOC-COOCH3(g)+4H2(g)⇌HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
为提高乙二醇的产量和速率,宜采用的措施是___(填字母).
A.升高温度 B.增大压强 C.增大氢气浓度
(5)草酸二甲酯水解生成草酸:CH3OOC-COOCH3=2H2O⇌2CH3OH+HOOC-COOH
①草酸是二元弱酸,可以制备KHC2O4 (草酸氢钾),KHC2O4溶液呈酸性,用化学平衡原理解释:___.
②在一定的KHC2O4溶液中滴加NaOH溶液至中性.下列关系一定不正确的是
___(填字母).
A.c(Na+)>c(K+)>c(C2O42-)>c(HC2O4-)
B.c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4)
C.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的___(填“正”或“负”)级,负极反应式为___.

322
4222
222
22
42
2332223
3323
2424
24
++242-24-
+24-242-224
++24-242-

(1)写出方法l在催化剂的条件下直接制取乙二醇的化学方程式___
(2)合成气在不同催化剂作用下,可以合成不同的物质.下列物质仅用合成气为原料就能得到且原子利用率为100%的是___(填字母).
A.草酸( HOOC-COOH) B.甲醇(CH3OH) C.尿素[CO(NH2)2]
(3)工业上还可以利用天然气(主要成分为CH.)与C02反应制备合成气.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
2CO(g)+O2(g)═2CO2(g)△H=-566.kJ/mol
则CH4与CO2生成合成气的热化学方程式为___.
(4)方法2:在恒容密闭容器中投入草酸二甲酯和H2发生如下反应:CH3OOC-COOCH3(g)+4H2(g)⇌HOCH2CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
为提高乙二醇的产量和速率,宜采用的措施是___(填字母).
A.升高温度 B.增大压强 C.增大氢气浓度
(5)草酸二甲酯水解生成草酸:CH3OOC-COOCH3=2H2O⇌2CH3OH+HOOC-COOH
①草酸是二元弱酸,可以制备KHC2O4 (草酸氢钾),KHC2O4溶液呈酸性,用化学平衡原理解释:___.
②在一定的KHC2O4溶液中滴加NaOH溶液至中性.下列关系一定不正确的是
___(填字母).
A.c(Na+)>c(K+)>c(C2O42-)>c(HC2O4-)
B.c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4)
C.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
(6)乙二醇、空气在KOH溶液中构成燃料电池,加入乙二醇的电极为电源的___(填“正”或“负”)级,负极反应式为___.

322
4222
222
22
42
2332223
3323
2424
24
++242-24-
+24-242-224
++24-242-
▼优质解答
答案和解析
(1)合成气的主要成分为CO和H22,在催化剂条件下合成乙二醇的反应:2CO+3H22
HOCH2CH2OH,故答案为:2CO+3H2
HOCH2CH2OH;
(2)根据质量守恒定律可知,合成气的主要成分为CO和H2,不含氮元素,故不可能合成出尿素,故C不选;而在A乙二酸中,C、O原子个数比为1:2,大于了CO中的1:1,故不能由合成气来合成,而B.甲醇(CH3OH) 可以由CO和H2按1:2来合成,全部原子均转化为目标产物,原子转化率达到了100%,故选B;
(3)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol ①
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol ②
2CO(g)+O2(g)═2CO2(g)△H=-566.kJ/mol ③
将①-②-③可得:
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=(-890.3kJ/mol)-(-571.6kJ/mol)-(-566.kJ/mol)=+247.3KJ/mol,故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3KJ/mol;
(4)A.升高温度,平衡左移,乙二醇的产量降低,故A不选;
B.增大压强,反应速率加快,平衡右移,乙二醇的产量增大,故B选;
C.增大氢气浓度,反应速率加快,平衡右移,乙二醇的产量增大,故C选.
故选BC.
(5)①HC2O4-既能水解又能电离:HC2O4-⇌H++C2O42-,电离显酸性;HC2O4-+H2O⇌H2C2O4+OH-,水解显碱性,而HHC2O4溶液显酸性,说明HC2O4-的电离大于其水解,故答案为:HC2O4-既能水解又能电离:HC2O4-⇌H++C2O42-;HC2O4-+H2O⇌H2C2O4+OH-,而HC2O4-的电离大于其水解.
②在一定的KHC2O4溶液中滴加NaOH溶液至中性,则加入的NaOH的量必须较少,将部分KHC2O4反应掉,则溶液中的溶质为:KHC2O4和K2C2O4和Na2C2O4,
A、由于加入的NaOH的量必须较少,将部分KHC2O4反应掉,故c(Na+)不可能大于c(K+),故A错误;
B、溶液中的K+和HC2O4-、H2C2O4和C2O42-均来自于KHC2O4,根据物料守恒可知:c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4),故B正确;
C、根据电荷守恒可知:c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故C错误.
故选AC.
(6)在燃料电池中,可燃物均发生氧化反应,均在负极放电;由于是碱性燃料电池,故负极乙二醇放电生成CO32-,电极方程式为:
HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O,故答案为:负,HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O;
催化剂 催化剂 催化剂 催化剂 HOCH22CH22OH,故答案为:2CO+3H22
HOCH2CH2OH;
(2)根据质量守恒定律可知,合成气的主要成分为CO和H2,不含氮元素,故不可能合成出尿素,故C不选;而在A乙二酸中,C、O原子个数比为1:2,大于了CO中的1:1,故不能由合成气来合成,而B.甲醇(CH3OH) 可以由CO和H2按1:2来合成,全部原子均转化为目标产物,原子转化率达到了100%,故选B;
(3)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol ①
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol ②
2CO(g)+O2(g)═2CO2(g)△H=-566.kJ/mol ③
将①-②-③可得:
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=(-890.3kJ/mol)-(-571.6kJ/mol)-(-566.kJ/mol)=+247.3KJ/mol,故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3KJ/mol;
(4)A.升高温度,平衡左移,乙二醇的产量降低,故A不选;
B.增大压强,反应速率加快,平衡右移,乙二醇的产量增大,故B选;
C.增大氢气浓度,反应速率加快,平衡右移,乙二醇的产量增大,故C选.
故选BC.
(5)①HC2O4-既能水解又能电离:HC2O4-⇌H++C2O42-,电离显酸性;HC2O4-+H2O⇌H2C2O4+OH-,水解显碱性,而HHC2O4溶液显酸性,说明HC2O4-的电离大于其水解,故答案为:HC2O4-既能水解又能电离:HC2O4-⇌H++C2O42-;HC2O4-+H2O⇌H2C2O4+OH-,而HC2O4-的电离大于其水解.
②在一定的KHC2O4溶液中滴加NaOH溶液至中性,则加入的NaOH的量必须较少,将部分KHC2O4反应掉,则溶液中的溶质为:KHC2O4和K2C2O4和Na2C2O4,
A、由于加入的NaOH的量必须较少,将部分KHC2O4反应掉,故c(Na+)不可能大于c(K+),故A错误;
B、溶液中的K+和HC2O4-、H2C2O4和C2O42-均来自于KHC2O4,根据物料守恒可知:c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4),故B正确;
C、根据电荷守恒可知:c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故C错误.
故选AC.
(6)在燃料电池中,可燃物均发生氧化反应,均在负极放电;由于是碱性燃料电池,故负极乙二醇放电生成CO32-,电极方程式为:
HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O,故答案为:负,HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O;
催化剂 催化剂 催化剂 催化剂 HOCH22CH22OH;
(2)根据质量守恒定律可知,合成气的主要成分为CO和H22,不含氮元素,故不可能合成出尿素,故C不选;而在A乙二酸中,C、O原子个数比为1:2,大于了CO中的1:1,故不能由合成气来合成,而B.甲醇(CH33OH) 可以由CO和H22按1:2来合成,全部原子均转化为目标产物,原子转化率达到了100%,故选B;
(3)已知:CH44(g)+2O22(g)═CO22(g)+2H22O(l)△H=-890.3kJ/mol ①
2H22(g)+O22(g)═2H22O(l)△H=-571.6kJ/mol ②
2CO(g)+O22(g)═2CO22(g)△H=-566.kJ/mol ③
将①-②-③可得:
CH44(g)+CO22(g)=2CO(g)+2H22(g)△H=(-890.3kJ/mol)-(-571.6kJ/mol)-(-566.kJ/mol)=+247.3KJ/mol,故答案为:CH44(g)+CO22(g)=2CO(g)+2H22(g)△H=+247.3KJ/mol;
(4)A.升高温度,平衡左移,乙二醇的产量降低,故A不选;
B.增大压强,反应速率加快,平衡右移,乙二醇的产量增大,故B选;
C.增大氢气浓度,反应速率加快,平衡右移,乙二醇的产量增大,故C选.
故选BC.
(5)①HC22O44--既能水解又能电离:HC22O44--⇌H+++C22O442-2-,电离显酸性;HC22O44--+H22O⇌H22C22O44+OH--,水解显碱性,而HHC22O44溶液显酸性,说明HC22O44--的电离大于其水解,故答案为:HC22O44--既能水解又能电离:HC22O44--⇌H+++C22O442-2-;HC22O44--+H22O⇌H22C22O44+OH--,而HC22O44--的电离大于其水解.
②在一定的KHC22O44溶液中滴加NaOH溶液至中性,则加入的NaOH的量必须较少,将部分KHC22O44反应掉,则溶液中的溶质为:KHC22O44和K22C22O44和Na22C22O44,
A、由于加入的NaOH的量必须较少,将部分KHC22O44反应掉,故c(Na++)不可能大于c(K++),故A错误;
B、溶液中的K++和HC22O44--、H22C22O44和C22O442-2-均来自于KHC22O44,根据物料守恒可知:c(K++)=c(HC22O44--)+c(C22O442-2-)+c(H22C22O44),故B正确;
C、根据电荷守恒可知:c(K++)+c(Na++)=c(HC22O44--)+2c(C22O442-2-)+c(OH--),故C错误.
故选AC.
(6)在燃料电池中,可燃物均发生氧化反应,均在负极放电;由于是碱性燃料电池,故负极乙二醇放电生成CO332-2-,电极方程式为:
HOCH22CH22OH-10e--+14OH--=2CO332-2-+10H22O,故答案为:负,HOCH22CH22OH-10e--+14OH--=2CO332-2-+10H22O;
| ||
| ||
(2)根据质量守恒定律可知,合成气的主要成分为CO和H2,不含氮元素,故不可能合成出尿素,故C不选;而在A乙二酸中,C、O原子个数比为1:2,大于了CO中的1:1,故不能由合成气来合成,而B.甲醇(CH3OH) 可以由CO和H2按1:2来合成,全部原子均转化为目标产物,原子转化率达到了100%,故选B;
(3)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol ①
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol ②
2CO(g)+O2(g)═2CO2(g)△H=-566.kJ/mol ③
将①-②-③可得:
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=(-890.3kJ/mol)-(-571.6kJ/mol)-(-566.kJ/mol)=+247.3KJ/mol,故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3KJ/mol;
(4)A.升高温度,平衡左移,乙二醇的产量降低,故A不选;
B.增大压强,反应速率加快,平衡右移,乙二醇的产量增大,故B选;
C.增大氢气浓度,反应速率加快,平衡右移,乙二醇的产量增大,故C选.
故选BC.
(5)①HC2O4-既能水解又能电离:HC2O4-⇌H++C2O42-,电离显酸性;HC2O4-+H2O⇌H2C2O4+OH-,水解显碱性,而HHC2O4溶液显酸性,说明HC2O4-的电离大于其水解,故答案为:HC2O4-既能水解又能电离:HC2O4-⇌H++C2O42-;HC2O4-+H2O⇌H2C2O4+OH-,而HC2O4-的电离大于其水解.
②在一定的KHC2O4溶液中滴加NaOH溶液至中性,则加入的NaOH的量必须较少,将部分KHC2O4反应掉,则溶液中的溶质为:KHC2O4和K2C2O4和Na2C2O4,
A、由于加入的NaOH的量必须较少,将部分KHC2O4反应掉,故c(Na+)不可能大于c(K+),故A错误;
B、溶液中的K+和HC2O4-、H2C2O4和C2O42-均来自于KHC2O4,根据物料守恒可知:c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4),故B正确;
C、根据电荷守恒可知:c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故C错误.
故选AC.
(6)在燃料电池中,可燃物均发生氧化反应,均在负极放电;由于是碱性燃料电池,故负极乙二醇放电生成CO32-,电极方程式为:
HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O,故答案为:负,HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O;
| ||
| 催化剂 |
. |
| 催化剂 |
. |
| 催化剂 |
. |
| 催化剂 |
. |
.
.
.
.
.
| ||
(2)根据质量守恒定律可知,合成气的主要成分为CO和H2,不含氮元素,故不可能合成出尿素,故C不选;而在A乙二酸中,C、O原子个数比为1:2,大于了CO中的1:1,故不能由合成气来合成,而B.甲醇(CH3OH) 可以由CO和H2按1:2来合成,全部原子均转化为目标产物,原子转化率达到了100%,故选B;
(3)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol ①
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol ②
2CO(g)+O2(g)═2CO2(g)△H=-566.kJ/mol ③
将①-②-③可得:
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=(-890.3kJ/mol)-(-571.6kJ/mol)-(-566.kJ/mol)=+247.3KJ/mol,故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.3KJ/mol;
(4)A.升高温度,平衡左移,乙二醇的产量降低,故A不选;
B.增大压强,反应速率加快,平衡右移,乙二醇的产量增大,故B选;
C.增大氢气浓度,反应速率加快,平衡右移,乙二醇的产量增大,故C选.
故选BC.
(5)①HC2O4-既能水解又能电离:HC2O4-⇌H++C2O42-,电离显酸性;HC2O4-+H2O⇌H2C2O4+OH-,水解显碱性,而HHC2O4溶液显酸性,说明HC2O4-的电离大于其水解,故答案为:HC2O4-既能水解又能电离:HC2O4-⇌H++C2O42-;HC2O4-+H2O⇌H2C2O4+OH-,而HC2O4-的电离大于其水解.
②在一定的KHC2O4溶液中滴加NaOH溶液至中性,则加入的NaOH的量必须较少,将部分KHC2O4反应掉,则溶液中的溶质为:KHC2O4和K2C2O4和Na2C2O4,
A、由于加入的NaOH的量必须较少,将部分KHC2O4反应掉,故c(Na+)不可能大于c(K+),故A错误;
B、溶液中的K+和HC2O4-、H2C2O4和C2O42-均来自于KHC2O4,根据物料守恒可知:c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4),故B正确;
C、根据电荷守恒可知:c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故C错误.
故选AC.
(6)在燃料电池中,可燃物均发生氧化反应,均在负极放电;由于是碱性燃料电池,故负极乙二醇放电生成CO32-,电极方程式为:
HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O,故答案为:负,HOCH2CH2OH-10e-+14OH-=2CO32-+10H2O;
| ||
| 催化剂 |
. |
| 催化剂 |
. |
| 催化剂 |
. |
| 催化剂 |
. |
.
.
.
.
.(2)根据质量守恒定律可知,合成气的主要成分为CO和H22,不含氮元素,故不可能合成出尿素,故C不选;而在A乙二酸中,C、O原子个数比为1:2,大于了CO中的1:1,故不能由合成气来合成,而B.甲醇(CH33OH) 可以由CO和H22按1:2来合成,全部原子均转化为目标产物,原子转化率达到了100%,故选B;
(3)已知:CH44(g)+2O22(g)═CO22(g)+2H22O(l)△H=-890.3kJ/mol ①
2H22(g)+O22(g)═2H22O(l)△H=-571.6kJ/mol ②
2CO(g)+O22(g)═2CO22(g)△H=-566.kJ/mol ③
将①-②-③可得:
CH44(g)+CO22(g)=2CO(g)+2H22(g)△H=(-890.3kJ/mol)-(-571.6kJ/mol)-(-566.kJ/mol)=+247.3KJ/mol,故答案为:CH44(g)+CO22(g)=2CO(g)+2H22(g)△H=+247.3KJ/mol;
(4)A.升高温度,平衡左移,乙二醇的产量降低,故A不选;
B.增大压强,反应速率加快,平衡右移,乙二醇的产量增大,故B选;
C.增大氢气浓度,反应速率加快,平衡右移,乙二醇的产量增大,故C选.
故选BC.
(5)①HC22O44--既能水解又能电离:HC22O44--⇌H+++C22O442-2-,电离显酸性;HC22O44--+H22O⇌H22C22O44+OH--,水解显碱性,而HHC22O44溶液显酸性,说明HC22O44--的电离大于其水解,故答案为:HC22O44--既能水解又能电离:HC22O44--⇌H+++C22O442-2-;HC22O44--+H22O⇌H22C22O44+OH--,而HC22O44--的电离大于其水解.
②在一定的KHC22O44溶液中滴加NaOH溶液至中性,则加入的NaOH的量必须较少,将部分KHC22O44反应掉,则溶液中的溶质为:KHC22O44和K22C22O44和Na22C22O44,
A、由于加入的NaOH的量必须较少,将部分KHC22O44反应掉,故c(Na++)不可能大于c(K++),故A错误;
B、溶液中的K++和HC22O44--、H22C22O44和C22O442-2-均来自于KHC22O44,根据物料守恒可知:c(K++)=c(HC22O44--)+c(C22O442-2-)+c(H22C22O44),故B正确;
C、根据电荷守恒可知:c(K++)+c(Na++)=c(HC22O44--)+2c(C22O442-2-)+c(OH--),故C错误.
故选AC.
(6)在燃料电池中,可燃物均发生氧化反应,均在负极放电;由于是碱性燃料电池,故负极乙二醇放电生成CO332-2-,电极方程式为:
HOCH22CH22OH-10e--+14OH--=2CO332-2-+10H22O,故答案为:负,HOCH22CH22OH-10e--+14OH--=2CO332-2-+10H22O;
看了 以煤为主要原料可以制备乙二醇...的网友还看了以下:
关于惯性的问题,我们老师讲到惯性的时候说道惯性的大小只与运动物体的质量有关,可有人说还与运动的速度 2020-05-16 …
【高中物理】关于物体的内能,下列说法中,正确的是:A理想气体温度升高时,内能可能减少B物体向外界放 2020-05-17 …
热能的本质是物体内部所有分子动能,可是热能顾名思义跟热量有关,难道可以理解为分子热运动所具有的动能 2020-06-04 …
关于物理内能,体积,物态的关系首先确认一句话“内能是分子动能和势能之和,如果是对仅两个分子的话,分 2020-06-14 …
内容是关于物物流运输的事情.下列费用为收货方付款.收货人委托发货人发一件物品因物品是裸件物流公司要 2020-07-06 …
下列有关食物储存与微生物关系的说法中错误的是()A.真空包装牛肉丸抑制了微生物的有氧呼吸B.腐乳中 2020-07-06 …
下列关于微生物的叙述,错误的是A.硝化细菌虽然不能进行光合作用,但属于自养生物B.蓝藻虽然无叶绿体, 2020-11-03 …
求一种物质?关于物质添加催化剂后物态变化的有没有物质在零摄氏度以上是液态,加催化剂后可以变成气态?有 2020-11-28 …
下列有关生物体遗传物质的叙述,正确的是()A.豌豆的遗传物质主要是DNAB.细菌的遗传物质是RNAC 2020-12-08 …
下列有关生物多样性的观念中,不恰当的是()A.生物多样性可以迅速提高人们的生活水平.B.生物多样性可 2021-01-19 …