甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO(g)+2H2(g)CH3OH(g)△H1②CO2(g)+3H2(g)CH3OH(g)+
甲醇是重要的化工原料,又可称为燃料。利用合![]() 成气(主要成分为CO、CO2和H2)在催化剂
成气(主要成分为CO、CO2和H2)在催化剂
的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知△H1=-99kJ·mol-1 ,△H3=+41kJ·mol-1,则△H2= kJ·mol-1。
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。
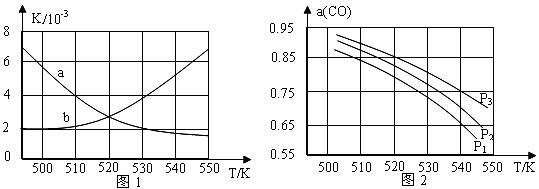
(3)若开始各气体的物质的量一定时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。则α(CO)值随温度升高而 (填“增大”或“减小”);图2中的压强由大到小为 ,其判断理由是 。
甲醇是重要的化工原料,又可称为燃料。利用合![]() 成气(主要成分为CO、CO2和H2)在催化剂
成气(主要成分为CO、CO2和H2)在催化剂
的作用下合成甲醇,发生的主反应如下:
的作用下合成甲醇,发生的主反应如下:①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
回答下列问题::(1)已知△H1=-99kJ·mol-1 ,△H3=+41kJ·mol-1,则△H2= kJ·mol-1。
(1)已知△H1=-99kJ·mol-1 ,△H3=+41kJ·mol-1,则△H2= kJ·mol-1。1)已知△H1=-99kJ·mol-1 ,△H3=+41kJ·mol-1,则△H2= kJ·mol-1。已知△H1=-99kJ·mol-1 ,△H3=+41kJ·mol-1,则△H2= kJ·mol-1。△H1=-99kJ·mol-1 ,△H3=+41kJ·mol-1,则△H2= kJ·mol-1。H1=-99kJ·mol-1 ,△H3=+41kJ·mol-1,则△H2= kJ·mol-1。1=-99kJ·mol-1 ,△H3=+41kJ·mol-1,则△H2= kJ·mol-1。-99kJ·mol-1 ,△H3=+41kJ·mol-1,则△H2= kJ·mol-1。-1 △H3=+41kJ·mol-1,则△H2= kJ·mol-1。H3=+41kJ·mol-1,则△H2= kJ·mol-1。3=+41kJ·mol-1,则△H2= kJ·mol-1。+41kJ·mol-1,则△H2= kJ·mol-1。-1则△H2= kJ·mol-1。△H2= kJ·mol-1。H2= kJ·mol-1。2= kJ·mol-1。 kJ·mol-1。-1。(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。 1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。


(3)若开始各气体的物质的量一定时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。则α(CO)值随温度升高而 (填“增大”或“减小”);图2中的压强由大到小为 ,其判断理由是 。
(3)若开始各气体的物质的量一定时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。则α(CO)值随温度升高而 (填“增大”或“减小”);图2中的压强由大到小为 ,其判断理由是 。3)若开始各气体的物质的量一定时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。则α(CO)值随温度升高而 (填“增大”或“减小”);图2中的压强由大到小为 ,其判断理由是 。CO平衡转化率(α)与温度和压强的关系如图2所示。则α(CO)值随温度升高而 (填“增大”或“减小”);图2中的压强由大到小为 ,其判断理由是 。α)与温度和压强的关系如图2所示。则α(CO)值随温度升高而 (填“增大”或“减小”);图2中的压强由大到小为 ,其判断理由是 。2所示。则α(CO)值随温度升高而 (填“增大”或“减小”);图2中的压强由大到小为 ,其判断理由是 。α(CO)值随温度升高而 (填“增大”或“减小”);图2中的压强由大到小为 ,其判断理由是 。CO)值随温度升高而 (填“增大”或“减小”);图2中的压强由大到小为 ,其判断理由是 。 “增大”或“减小”);图2中的压强由大到小为 ,其判断理由是 。”或“减小”);图2中的压强由大到小为 ,其判断理由是 。“减小”);图2中的压强由大到小为 ,其判断理由是 。”);图2中的压强由大到小为 ,其判断理由是 。2中的压强由大到小为 ,其判断理由是 。【答案】(每空2分,共14分)
(1)-58
(2)![]() ; a; 反应①为放热反应,温度升高,平衡左移,平衡常数变小;
; a; 反应①为放热反应,温度升高,平衡左移,平衡常数变小;
(3)减小; P3>P2>P1;
反应①为气体分子数减小的反应,加压,平衡右移,CO的转化率增大;而反应③为气体分子数不变的反应,加压,平衡不移动,CO的转化率不变,故增大压强,CO的转化率增大。
【解析】
试题分析:
(1)根据盖斯定律:反应②-反应①=反应③,故△H2=△H3+△H1=(+41kJ.mol-1)+(-99kJ.mol-1)=-58kJ.mol-1,
(2)反应①CO(g)+2H2(g)⇌CH3OH(g)的平衡常数表达式K=![]() ;
;
反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,曲线a正确反映平衡常数K随温度变化关系,
(3)由图可知,压强一定时,随温度的升高,CO的转化率减小,反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小;
相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于![]() CO的转化率升高,故压强:P1>P2>P3,
CO的转化率升高,故压强:P1>P2>P3,
考点:考查反应热计算、盖斯定律应用、平衡常数以及外界条件对平衡状态的影响等
【答案】(每空2分,共14分)
【答案】(每空2分,共14分)(1)-58
(1)-58(2)![]() ; a; 反应①为放热反应,温度升高,平衡左移,平衡常数变小;
; a; 反应①为放热反应,温度升高,平衡左移,平衡常数变小;
(3)减小; P3>P2>P1;
(3)减小; P33>P22>P11;反应①为气体分子数减小的反应,加压,平衡右移,CO的转化率增大;而反应③为气体分子数不变的反应,加压,平衡不移动,CO的转化率不变,故增大压强,CO的转化率增大。
反应①为气体分子数减小的反应,加压,平衡右移,CO的转化率增大;而反应③为气体分子数不变的反应,加压,平衡不移动,CO的转化率不变,故增大压强,CO的转化率增大。【解析】
【解析】试题分析:
试题分析:(1)根据盖斯定律:反应②-反应①=反应③,故△H2=△H3+△H1=(+41kJ.mol-1)+(-99kJ.mol-1)=-58kJ.mol-1,
(2)反应①CO(g)+2H2(g)⇌CH3OH(g)的平衡常数表达式K=![]() ;
;
反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,曲线a正确反映平衡常数K随温度变化关系,
(2)反应①CO(g)+2H22(g)⇌CH33OH(g)的平衡常数表达式K=
反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,曲线a正确反映平衡常数K随温度变化关系,
(3)由图可知,压强一定时,随温度的升高,CO的转化率减小,反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小;
相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于![]() CO的转化率升高,故压强:P1>P2>P3,
CO的转化率升高,故压强:P1>P2>P3,
相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于
考点:考查反应热计算、盖斯定律应用、平衡常数以及外界条件对平衡状态的影响等
考点:考查反应热计算、盖斯定律应用、平衡常数以及外界条件对平衡状态的影响等
下列有关常见有机物说法正确的是()A.糖类、油脂和蛋白质都是人体必需的营养物质,都属于高分子化合物 2020-04-08 …
下列每组中各有三对物质,它们都能用分液漏斗分离的是()A.乙酸乙酯和水,酒精和水,苯酚和水B.二溴 2020-04-25 …
下列关于有机物的说法正确的是()A.苯乙烯分子中所有原子可能在同一个平面上B.分子式为C7H8O且 2020-05-14 …
②下列选项中,最适合作为步骤c的洗涤液是。 A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫 2020-05-25 …
能用分液漏斗分离的是()A.苯和苯酚B.溴苯和水C.乙醇和溴水D.乙醇和乙酸 2020-06-04 …
下列关于有机物的说法不正确的是()A.乙醇、乙烷和乙酸都可以与钠反应生成氢气B.组成人体蛋白质的氨 2020-06-18 …
下列关于有机物的说法正确的是()A.分子式为C5H11Cl的有机物有8种同分异构体B.塑料的老化是 2020-07-09 …
下列化学反应类型既属于加成反应又属于还原反应A氢气与苯反应B乙炔和氯化氢反应C乙醇和钠反应D乙醇和 2020-07-25 …
下列物质中,不互为同分异构体的一组物质是()A.丙酰胺和丙胺B.丁醇和乙醚C.乙醇和二甲醚D.丁醇和 2020-11-29 …
下列有关说法中,正确的是()A.乙醇和乙醚互为同分异构体B.干馏煤可以得到甲烷、苯和氨等重要化工原料 2020-12-21 …