早教吧作业答案频道 -->化学-->
(一)某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能;一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3SO32-+6H2O=2Fe2++2Fe(OH)3(胶
题目详情
(一)某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能;一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3SO32-+6H2O=2Fe2++2Fe(OH)3(胶体)+3H2SO4,为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ:学生选择的实验用品:Na2SO3浓溶液,BaCl2稀溶液,稀盐酸,试管若干,胶头滴管若干,从选择的药品分析,设计这个实验的目的是___.
实验Ⅱ:取5mL FeCl3浓溶液于试管中,再滴加入 Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色,这种红褐色液体是___向红褐色液体中加入稀盐酸至过量,将所得溶液分为两等份,其中一份加入KSCN溶液变成血红色,反应的离子方程式为___.另一份加入BaCl2稀溶液有少量白色沉淀生成,产生该白色沉淀的离子方程式是___.
实验Ⅲ:换成两种稀溶液重复实验Ⅱ,产生现象完全相同,由上述实验得出的结论是___
若在FeCl3溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是___.
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看出,二者的水溶液与FeCl3溶液反应现象差别很大,分析其可能的原因是:①___;②___.
(二)镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.NiSO4•xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下:
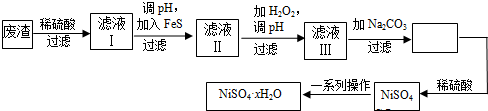
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为___.
②滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是___.(一)某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能;一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3SO32-+6H2O=2Fe2++2Fe(OH)3(胶体)+3H2SO4,为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ:学生选择的实验用品:Na2SO3浓溶液,BaCl2稀溶液,稀盐酸,试管若干,胶头滴管若干,从选择的药品分析,设计这个实验的目的是___.
实验Ⅱ:取5mL FeCl3浓溶液于试管中,再滴加入 Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色,这种红褐色液体是___向红褐色液体中加入稀盐酸至过量,将所得溶液分为两等份,其中一份加入KSCN溶液变成血红色,反应的离子方程式为___.另一份加入BaCl2稀溶液有少量白色沉淀生成,产生该白色沉淀的离子方程式是___.
实验Ⅲ:换成两种稀溶液重复实验Ⅱ,产生现象完全相同,由上述实验得出的结论是___
若在FeCl3溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是___.
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看出,二者的水溶液与FeCl3溶液反应现象差别很大,分析其可能的原因是:①___;②___.
(二)镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.NiSO4•xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下:

①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为___.
②滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是___.3+32-3+32-22+42-+3+32-22+324
232
323232
323
23233
42

2+2+2+
4234
实验Ⅰ:学生选择的实验用品:Na2SO3浓溶液,BaCl2稀溶液,稀盐酸,试管若干,胶头滴管若干,从选择的药品分析,设计这个实验的目的是___.
实验Ⅱ:取5mL FeCl3浓溶液于试管中,再滴加入 Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色,这种红褐色液体是___向红褐色液体中加入稀盐酸至过量,将所得溶液分为两等份,其中一份加入KSCN溶液变成血红色,反应的离子方程式为___.另一份加入BaCl2稀溶液有少量白色沉淀生成,产生该白色沉淀的离子方程式是___.
实验Ⅲ:换成两种稀溶液重复实验Ⅱ,产生现象完全相同,由上述实验得出的结论是___
若在FeCl3溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是___.
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看出,二者的水溶液与FeCl3溶液反应现象差别很大,分析其可能的原因是:①___;②___.
(二)镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.NiSO4•xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下:

①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为___.
②滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是___.(一)某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能;一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3SO32-+6H2O=2Fe2++2Fe(OH)3(胶体)+3H2SO4,为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ:学生选择的实验用品:Na2SO3浓溶液,BaCl2稀溶液,稀盐酸,试管若干,胶头滴管若干,从选择的药品分析,设计这个实验的目的是___.
实验Ⅱ:取5mL FeCl3浓溶液于试管中,再滴加入 Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色,这种红褐色液体是___向红褐色液体中加入稀盐酸至过量,将所得溶液分为两等份,其中一份加入KSCN溶液变成血红色,反应的离子方程式为___.另一份加入BaCl2稀溶液有少量白色沉淀生成,产生该白色沉淀的离子方程式是___.
实验Ⅲ:换成两种稀溶液重复实验Ⅱ,产生现象完全相同,由上述实验得出的结论是___
若在FeCl3溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是___.
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看出,二者的水溶液与FeCl3溶液反应现象差别很大,分析其可能的原因是:①___;②___.
(二)镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.NiSO4•xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下:

①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为___.
②滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是___.3+32-3+32-22+42-+3+32-22+324
232
323232
323
23233
42

2+2+2+
4234
▼优质解答
答案和解析
实验Ⅰ:学生选择的实验用品:Na22SO33浓溶液、BaCl22稀溶液、稀盐酸,目的是检验亚硫酸钠是否被氧化成了硫酸钠,
故答案为:检验Na22SO33是否变质(或检验Na22SO33溶液中是否混有Na22SO44);
实验Ⅱ:FeCl33浓溶液于试管中,逐滴加入Na22SO33浓溶液,铁离子能够与亚硫酸根离子发生水解生成了红褐色的氢氧化铁胶体;
加入KSCN溶液,溶液变为血红色,反应反应的离子方程式为:Fe3+3++3SCN--═Fe(SCN)33,另一份加入BaCl22稀溶液有少量白色沉淀生成,产生该白色沉淀的离子方程式是:Ba2+2++SO442-2-═BaSO44↓,
故答案为:氢氧化铁胶体;Fe3+3++3SCN--=Fe(SCN)33; Ba2+2++SO442-2-═BaSO44↓;
实验Ⅲ:换用稀释的FeCl33和Na22SO33溶液重复实验Ⅱ,产生的现象完全相同,证明了Fe3+3+与SO332-2-发生氧化还原反应和双水解反应是同时进行的,
在FeCl33浓溶液中加Na22CO33浓溶液,观察到红褐色沉淀并且产生无色气体,二者发生了双水解反应,反应的化学方程式为:2FeCl33+3Na22CO33+3H22O=2Fe(OH)33↓+3CO22↑+6NaCl;
从形式上看,Na22CO33和Na22SO33相似,但是从上述实验中可以看出,二者的水溶液与FeCl33溶液反应现象差别很大,分析其可能的原因是:
由于亚硫酸根离子具有较强的还原性,能够与铁离子发生氧化还原反应,而碳酸根离子没有还原性;
铁离子与亚硫酸根离子生成了氢氧化铁胶体,与碳酸根离子反应生成了氢氧化铁沉淀,说明碳酸根离子水解能力比亚硫酸根离子大,
故答案为:Fe3+3+与SO332-2-同时发生氧化还原反应和双水解反应;2FeCl33+3Na22CO33+3H22O=2Fe(OH)33↓+3CO22↑+6NaCl;SO332-2-有较强的还原性,CO332-2-没有还原性;SO332-2-水解能力较CO332-2-小;
(二)电镀废渣(除镍外,还含有铜、锌、铁等元素),过滤后在滤液中加入FeS,生成CuS、ZnS,可除去Cu2+2+、Zn2+2+等杂质,对滤液Ⅱ先加W,应为过氧化氢,可氧化Fe2+2+生成Fe3+3+,有利于水解生成氢氧化铁沉淀而除去,过滤后在滤液中加入碳酸钠,可生成NiCO33,过滤后加入硫酸可生成NiSO44,经蒸发、浓缩、冷却结晶可得到硫酸镍晶体,
①向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,说明CuS的溶解度更小,反应的离子方程式为FeS(aq)+Cu2+2+(aq)=Fe2+2+(aq)+CuS(aq),
故答案为:FeS(aq)+Cu2+2+(aq)=Fe2+2+(aq)+CuS(aq);
②滤液Ⅲ溶质的主要成分是NiSO44,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO44,可增大成NiSO44浓度,有利于蒸发结晶,
故答案为:增大NiSO44浓度,富集Ni元素,有利于蒸发结晶.
故答案为:检验Na22SO33是否变质(或检验Na22SO33溶液中是否混有Na22SO44);
实验Ⅱ:FeCl33浓溶液于试管中,逐滴加入Na22SO33浓溶液,铁离子能够与亚硫酸根离子发生水解生成了红褐色的氢氧化铁胶体;
加入KSCN溶液,溶液变为血红色,反应反应的离子方程式为:Fe3+3++3SCN--═Fe(SCN)33,另一份加入BaCl22稀溶液有少量白色沉淀生成,产生该白色沉淀的离子方程式是:Ba2+2++SO442-2-═BaSO44↓,
故答案为:氢氧化铁胶体;Fe3+3++3SCN--=Fe(SCN)33; Ba2+2++SO442-2-═BaSO44↓;
实验Ⅲ:换用稀释的FeCl33和Na22SO33溶液重复实验Ⅱ,产生的现象完全相同,证明了Fe3+3+与SO332-2-发生氧化还原反应和双水解反应是同时进行的,
在FeCl33浓溶液中加Na22CO33浓溶液,观察到红褐色沉淀并且产生无色气体,二者发生了双水解反应,反应的化学方程式为:2FeCl33+3Na22CO33+3H22O=2Fe(OH)33↓+3CO22↑+6NaCl;
从形式上看,Na22CO33和Na22SO33相似,但是从上述实验中可以看出,二者的水溶液与FeCl33溶液反应现象差别很大,分析其可能的原因是:
由于亚硫酸根离子具有较强的还原性,能够与铁离子发生氧化还原反应,而碳酸根离子没有还原性;
铁离子与亚硫酸根离子生成了氢氧化铁胶体,与碳酸根离子反应生成了氢氧化铁沉淀,说明碳酸根离子水解能力比亚硫酸根离子大,
故答案为:Fe3+3+与SO332-2-同时发生氧化还原反应和双水解反应;2FeCl33+3Na22CO33+3H22O=2Fe(OH)33↓+3CO22↑+6NaCl;SO332-2-有较强的还原性,CO332-2-没有还原性;SO332-2-水解能力较CO332-2-小;
(二)电镀废渣(除镍外,还含有铜、锌、铁等元素),过滤后在滤液中加入FeS,生成CuS、ZnS,可除去Cu2+2+、Zn2+2+等杂质,对滤液Ⅱ先加W,应为过氧化氢,可氧化Fe2+2+生成Fe3+3+,有利于水解生成氢氧化铁沉淀而除去,过滤后在滤液中加入碳酸钠,可生成NiCO33,过滤后加入硫酸可生成NiSO44,经蒸发、浓缩、冷却结晶可得到硫酸镍晶体,
①向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,说明CuS的溶解度更小,反应的离子方程式为FeS(aq)+Cu2+2+(aq)=Fe2+2+(aq)+CuS(aq),
故答案为:FeS(aq)+Cu2+2+(aq)=Fe2+2+(aq)+CuS(aq);
②滤液Ⅲ溶质的主要成分是NiSO44,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO44,可增大成NiSO44浓度,有利于蒸发结晶,
故答案为:增大NiSO44浓度,富集Ni元素,有利于蒸发结晶.
看了 (一)某化学研究性学习小组讨...的网友还看了以下:
针对2到3种溶化焊接方法,讨论他们形成焊接接头过程的本质区别.手工电弧焊,气体保护焊,埋弧自动焊等 2020-06-07 …
现将二倍体生物YyRR与YYrr两个体的配子进行融合(只考虑两两融合)可以得到3种基因型的细胞两两 2020-06-10 …
素菜4种,荤菜3种,两荤一素有几种选法 2020-06-28 …
某同学家的厨房里有两个外观完全相同的玻璃瓶,瓶中分别装有食盐和纯碱两种白色粉末.你如何利用家中的条 2020-07-14 …
六本书放在四个不同的盒子中,每个盒子最少放一本,有几种方法?可分两种。1.1.1.3和1.1.2. 2020-07-16 …
求与双曲线有公共渐近线的双曲线求与双曲线x^2/9-y^2/16=1有公共渐近线,且过点A(-3, 2020-08-01 …
遇见limn趋于0,式中有a的n次方的,只有条件(a>0)如何讨论?是不是先分三种情况:a>1,1> 2020-12-23 …
英语翻译1You(无论多么小心都不为过)whenyoudriveacar.2weareallfory 2020-12-23 …
集合M={x|x=(k/2)*180°+45°,k∈Z},N={x|x=(k/4)*180°+45° 2020-12-23 …
探讨数轴两点间的距离(1)数轴上表示2和5的两点间的距离是,数轴上表示-3与-7的两点间的距离是,数 2021-01-12 …